
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
Ⅰ.制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
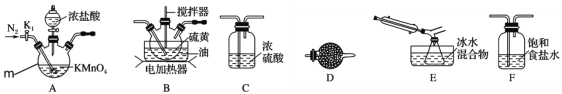
(1)仪器m的名称为___,装置A中发生反应的离子方程式为 ______________。
(2)装置连接顺序:A→___→___→___→E→D。______________
(3)为了提高S2Cl2的纯度,实验的关键是控制好温度和__________________。
(4)若D中所装试剂为碱石灰,则该装置的作用为______________。
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.8g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 ;Ksp(AgSCN)=2×10-12
(5)滴定终点的现象为_____________________________。
(6)产品中SO2Cl2的质量分数为__________,若步骤③不加入硝基苯则所测SO2Cl2含量将________(填“偏高”、“偏低”或“无影响”)。
【答案】三颈烧瓶 2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O FCB 滴入浓盐酸的速率(或B中通入氯气的量) 防止空气中的水蒸气进入E中,吸收多余的氯气 溶液变为红色,而且半分钟内不褪色 71.25% 偏低
【解析】
(1)根据仪器m的形状可知其为三颈烧瓶;装置A为利用高锰酸钾氧化浓盐酸生成氯气的装备,该过程中高锰酸根被还原,氯离子被氧化生成氯气,离子方程式为:2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O;
(2)本实验需要用硫与少量氯气在 110~140℃反应制备S2Cl2 粗品,根据题目信息“熔点-76℃,沸点138℃”,制备的产品为气体,需要冷凝收集;受热或遇水分解放热,所以温度要控制好,同时还要在无水环境进行制备,则氯气需要干燥除杂,且制备装置前后都需要干燥装置,且氯气有毒需要进行尾气处理;所以装置连接顺序为A、F、C、B、E、D;
(3)反应中氯气过量则会生成SCl2,温度过高S2Cl2会分解,为了提高S2Cl2的纯度,实验的关键是控制好温度和滴入浓盐酸的速率或B中通入氯气的量;
(4)根据分析可知该装置的作用为防止空气中的水蒸气进入E中,同时吸收多余的氯气;
(5)SO2C12加入足量Ba(OH)2溶液,溶液中含有氯离子,加入硝酸酸化硝酸银生成AgCl沉淀,过量的硝酸银与NH4SCN溶液反应生成AgSCN沉淀,滴定终点银离子完全反应,SCN-与铁离子发生显色反应,滴定终点溶液呈红色,所以现象为:溶液变为红色,而且半分钟内不褪色;
(6)加入0.2000molL-1的AgNO3溶液l00.00 mL,则n(AgNO3)=0.02000mol,用0.1000molL-1 NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL,则n(AgSCN)=0.001mol,则n(SO2Cl2)=![]() ×(0.02000mol-0.001mol)=0.0095mol,所以产率为
×(0.02000mol-0.001mol)=0.0095mol,所以产率为![]() =71.25%;根据题目信息Ksp(AgCl)=3.2×10-10 ,Ksp(AgSCN)=2×10-12,AgSCN更容易沉淀,若不加入硝基苯,部分AgCl转化为AgSCN沉淀,造成测定结果偏低。
=71.25%;根据题目信息Ksp(AgCl)=3.2×10-10 ,Ksp(AgSCN)=2×10-12,AgSCN更容易沉淀,若不加入硝基苯,部分AgCl转化为AgSCN沉淀,造成测定结果偏低。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向0.10mol·L-1的H2C2O4(二元弱酸)溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法不正确的是

A. 25℃时H2C2O4的一级电离常数为Ka1=104.3
B. pH=2.7的溶液中:c(H2C2O4)=c(C2O42-)
C. pH=7的溶液中:c(Na+)>2c(C2O42-)
D. 滴加NaOH溶液的过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(![]() )是一种易分解、易水解的白色固体,可用于化肥、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵。反应式:
)是一种易分解、易水解的白色固体,可用于化肥、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵。反应式:![]() 。
。

(1)如果使用如图所示的装置制取![]() ,你所选择的试剂是__________________。
,你所选择的试剂是__________________。
(2)制备氨基甲酸铵的装置如图,把氨和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,当悬浮物较多时,停止制备。(注:四氯化碳与液体石蜡均为惰性介质。)
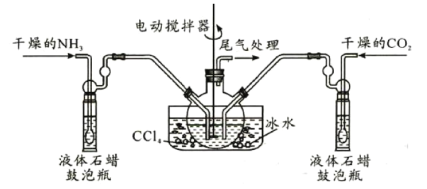
①发生器用冰水冷却的原因是________________________________________________;液体石蜡鼓泡瓶的作用是__________________________;发生反应的仪器名称是_______________。
②从反应后的混合物中过滤分离出产品。为了得到干燥产品,应采取的方法是_______________(选填序号)
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
(3)尾气有污染,吸收处理所用试剂为浓硫酸,它的作用是_________________________。
(4)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品![]() ,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为
,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为![]() 。样品中氨基甲酸铵的质量分数为_______________。[已知
。样品中氨基甲酸铵的质量分数为_______________。[已知![]() ]
]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列五种有机物中:A.CH4;B.CH2=CH2;C.CH3CH2OH;D.CH3COOH;E.淀粉。
(1)C分子中含有的官能团的名称是_____;
(2)A分子的结构式是_____;
(3)水溶液显酸性的是_____(填编号);
(4)可用于合成聚乙烯塑料的是_____(填编号),化学反应方程式为_____________________ ;
(5)通常用于检验碘单质的是_____(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国马丁·卡普拉等三位科学家因“在开发多尺度复杂化学系统模型”方面所做的贡献,获得了2013年诺贝尔化学奖。他们模拟出了1, 6-二苯基-1,3,5-己三烯的分子模型,其结构简式如图所示。下列说法正确的是 ( )
![]()
A. 该有机物属于芳香烃,与苯互为同系物
B. 该有机物的分子式为C18H18
C. 1 mol该有机物在常温下最多能与9 mol Br2发生加成反应
D. 该有机物可以发生氧化反应、取代反应、加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(g)+nB(g)=eC(g)+fD(s) △H。若按反应物的化学计量数比投料,在一定条件下进行反应,该反应达到平衡时C的气体体积分数与温度、压强的关系如图所示。下列叙述正确的是
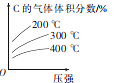
A.该反应的△H >0
B.该化学方程式中m+n>e+f
C.加入催化剂可加快正反应速率,逆反应速率不变
D.往平衡后的恒压容器中再充入一定量C,达到新平衡时,C的浓度与原平衡时的相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,分别向等体积pH均为a的CH3COOH溶液和HCN溶液中加水稀释,稀释过程中溶液的pH变化与溶液体积的关系如图所示:
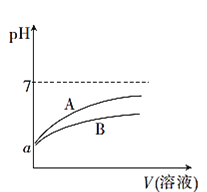
已知25℃时,HCN的电离平衡常数Ka=6.2×10-10,CH3COOH的电离平衡常数Ka=1.7×10-5
(1)表示CH3COOH溶液的pH变化趋势的曲线是____(填“A”或“B”)。
(2)pH均为a的CH3COOH溶液和HCN溶液,溶质的物质的量浓度较大的是____(填化学式)。
(3)25℃时,等浓度的NaCN溶液的pH___填“>”=”或“<”)CH3 COONa溶液的pH。
(4)25℃时,向20mL0.01mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1KOH溶液,当pH=7时,所加KOH溶液的体积____(填或“<”)20mL。
(5)用相同浓度的AgNO3溶液分别滴定浓度相同的含Cl-、Br-及I-的混合溶液,由图可确定首先沉淀的离子是______。(填离子符号)
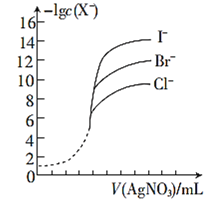
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某石油化工产品X的转化关系如图,下列判断不正确的是( )
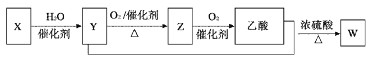
A. X可以发生加聚反应B. Y能与钠反应产生氢气
C. Z与CH3OCH3互为同分异构体D. W的结构简式为CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,其中浓硫酸除了做吸水剂和脱水剂的作用外还有_________;
[装置设计]甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是__(选填“甲”或“乙”).丙同学将甲装置中的玻璃管改成了球形干燥管除起冷凝作用外,它的另一重要作用是_________;
[实验步骤](1)按选择的装置组装仪器,在试管中先加入3mI乙醇,2m1冰醋酸,并在摇动下缓缓加入2mI浓硫酸充分摇匀,(2)将试管固定在铁架上;(3)在试管②中加入适量的饱和Na2CO3溶液;(4)用酒精灯对试管①加热;(5)当观察到试管②中有明显现象时停止实验。

[问题讨论]a.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有:无色油状液体、____;
b.试管②中饱和Na2CO3的作用是溶解乙醇、降低乙酸乙酯的溶解度还有______的作用;
c.从试管②中分离出乙酸乙酯的实验操作是______;
d、生成乙酸乙酯的化学反应方程______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com