
【题目】KClO4具有强氧化性,可用作炸药等。实验室由KClO3分解制备KClO4的流程如图:

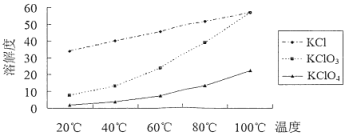
已知KClO3熔融易烧结,400℃以上分解放出氧气,各物质溶解度如下图。下列说法不正确的是
A.实验室制备KClO4的原理为![]()
B.趁热过滤的目的是除去KCl
C.操作①是冷却结晶、过滤、洗涤,操作②是重结晶
D.加热分解时,如果温度过高会使产率下降
【答案】B
【解析】
根据流程:KClO3加热至100℃使之熔融,加热30min分解:4KClO3 ![]() 3KClO4+KCl,冷却,固体为KClO4,含有KCl、KClO3,加水溶解煮沸,为减少KClO3结晶析出损失,趁热过滤,将滤液冷却结晶、过滤、洗涤,得到主要含有KClO4,少量的KCl、KClO3,重结晶得到、干燥得到产品,据此分析作答。
3KClO4+KCl,冷却,固体为KClO4,含有KCl、KClO3,加水溶解煮沸,为减少KClO3结晶析出损失,趁热过滤,将滤液冷却结晶、过滤、洗涤,得到主要含有KClO4,少量的KCl、KClO3,重结晶得到、干燥得到产品,据此分析作答。
A.实验室由KClO3分解制备KClO4,根据化合价有升有降,还有KCl生成,反应为:4KClO3![]() 3KClO4+KCl,故A正确;
3KClO4+KCl,故A正确;
B.由流程可知趁热过滤后KClO4在滤液中,由图KCl的溶解度比KClO4大,故KCl也在滤液中,故B错误;
C.KClO4的溶解度随温度的升高而增大,操作①后得到粗产品,故从滤液中得到产品为冷却结晶、过滤、洗涤,经过操作②粗产品得到精产品,由图可知,产品与杂质的溶解度随温度的变化较大,故为重结晶,故C正确;
D.加热分解时,如果温度过高,KClO3分解放出氧气,2KClO3![]() 3O2↑+2KCl,产率下降,故D正确;
3O2↑+2KCl,产率下降,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】下列有关滴定的说法正确的是( )
A. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
B. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中有NaOH杂质,则结果偏低
C. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高猛酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为![]() mol/L
mol/L
D. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Mg、Al组成的mg混合物投入一定量稀HCl中,固体完全溶解,收集到气体为1.12L(标准状况),向反应后溶液中加入2 mol/L NaOH溶液60mL时,金属离子恰好沉淀完全,则形成沉淀的质量为( )
A.(m+1.7)gB.(m+2.04)gC.(m+3.4)gD.(m+4.08)g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器中发生![]() △H=-a kJ·mol-1(a>0),反应过程中速率随时间的变化如图所示,下列说法不正确的是
△H=-a kJ·mol-1(a>0),反应过程中速率随时间的变化如图所示,下列说法不正确的是

A.t1时刻X的正反应速率等于Z的正反应速率
B.t2时刻可逆反应达到平衡状态
C.t2时刻以后,平均反应速率为0,说明反应不再发生
D.0~t2时间内反应放出的热量可能是akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,纳米0价金属能去除地下水中的NO3-,不同初始pH和不同金属组成对NO3-的去除效果如图所示。图1初始pH=5.5,图2初始pH=2,NO3-初始浓度均为50mg·L-1,纳米级金属添加量均为2g·L-1。下列说法正确的是
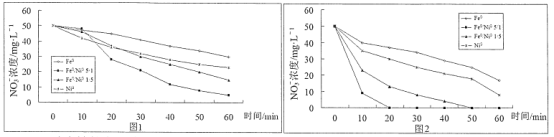
A.纳米铁的去除效果优于纳米镍
B.图2纳米铁反应60mn时NO3-去除率67.2%,则60min内![]()
C.当加入的金属是Fe0/Ni05/1,在不同的初始pH下,经过60min后,NO3-的去除率相等
D.其他条件相同时,若pH过低,可能会导致去除率下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废铝屑中含有少量杂质Al2O3、SiO2。取一定量该废铝屑样品,加入2mol/L的硫酸溶液,消耗600mL硫酸溶液时样品不再溶解,收集到标准状况下的气体8.96 L,过滤。欲使滤液中的金属离子完全沉淀,至少应加入3mol/LNaOH溶液的体积是
A.300mLB.600mLC.800mLD.900mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol某烃在氧气中充分燃烧生成CO2和H2O,需要消耗标准状况下的氧气179.2L。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是
A.CH3CH2CH2CH2CH3B.![]()
C.![]() D.
D.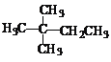
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
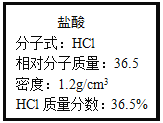
(一)该浓盐酸的物质的量浓度为______mol/L.
(二)某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为0.3mol/L稀盐酸,可供选用的仪器有:①胶头滴管②烧瓶③烧杯④药匙⑤量筒⑥托盘天平⑦玻璃棒 ,请回答下列问题:
(1)配制稀盐酸时,上述仪器中不需要使用的有______(选填序号),还缺少的仪器有______(写仪器名称).
(2)下列对容量瓶及其使用方法的描述中正确的是______.
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后,必须烘干
C.容量瓶可用来长期储存溶液
D.使用前要检查容量瓶是否漏水
(3)该学生需要量取______mL上述浓盐酸来配制。
(4)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)________________________;
A.用30mL水洗涤烧杯2--3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(5)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏高”或“偏低”或“无影响”).
I、用量筒量取浓盐酸时俯视观察凹液面______
II、用量筒量取浓盐酸后,洗涤量筒2--3次,洗涤液也转移到容量瓶______
III、溶液注入容量瓶前没有恢复到室温就进行定容______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述中正确的是
A. 标准状况下,22.4 L水中含有的水分子数为NA
B. 1 mol Fe与足量的盐酸反应电子转移总数为3NA
C. 常温常压下,22 g CO2中含有的氧原子数为NA
D. 500 mL 1 mol·L-1MgCl2溶液中含有Cl﹣数目为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com