
【题目】现有下列十种物质:①蔗糖 ②熔融NaCl ③石墨 ④铜丝 ⑤NaOH固体 ⑥SO2 ⑦NaHSO4固体 ⑧K2O固体 ⑨液态H2SO4 ⑩饱和FeCl3溶液
(1)上述物质中可导电的是_________(填序号,下同);上述物质中不能导电,但属于电解质的是_______。
(2)NaHSO4是一种酸式盐,当NaHSO4与Ba(OH)2溶液混合时溶液呈中性,该反应的离子方程式为____________。
(3)实验室制备少量Fe(OH)3胶体所用的物质有______(填序号)和蒸馏水,反应的离子方程式为__________。
(4)某强酸性反应体系中,反应物和生成物共六种为:O2、MnO4-、H2O、Mn2+、H2O2、H+,已知该反应中H2O2只发生了如下过程:H2O2→O2。写出该反应的离子方程式:___________。
【答案】②③④⑩ ⑤⑦⑧⑨ 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O ⑩ Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
Fe(OH)3(胶体)+3H+ 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
【解析】
(1)根据物质导电的原因分析,只要含有自由移动的离子或自由电子即可;在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水,只有熔融态的电解质才能导电;非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
(2)①NaHSO4晶体在水溶液中电离出钠离子和硫酸根离子、氢离子,根据溶液显中性可知NaHSO4与Ba(OH)2的物质的量的比是2:1书写离子方程式;
(3)将FeCl3饱和溶液滴入沸水中煮沸至液体呈红褐色得到氢氧化铁胶体分析;
(4)由H2O2→O2知,双氧水在反应中作还原剂,所以还必须有氧化剂参加反应,在反应中得电子,元素的化合价降低,根据化合价知,高锰酸根离子作氧化剂,还原产物是锰离子,同时反应后生成水,据此写出离子方程式。
(1)①蔗糖是非电解质,无自由移动的离子和电子,不能导电;②熔融的NaCl中有自由移动的离子,所以能导电;③石墨中含有自由移动的电子,能够导电;④铜丝中有自由电子,所以能导电;⑩饱和FeCl3溶液中含有自由移动的离子,可以导电;⑤NaOH固体、⑦CuSO4固体、⑧K2O固体、⑨液态H2SO4没有自由移动的离子或自由电子,属于电解质,但不能导电。故上述物质中可导电的是②③④⑩;上述物质中不能导电,但属于电解质的是⑤⑦⑧⑨;
(2)NaHSO4晶体在水溶液中电离出钠离子和硫酸根离子、氢离子,当NaHSO4与Ba(OH)2溶液混合时溶液呈中性时,二者的物质的量的比是2:1,反应的离子方程式为:电离方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(3)将FeCl3饱和溶液滴入沸水中,继续加热至液体呈红褐色,就得到Fe(OH)3胶体,属于使用的物质是⑩饱和FeCl3溶液,制备反应的离子方程式为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;
Fe(OH)3(胶体)+3H+;
(4)MnO4-具有氧化性,H2O2具有还原性,H2O2只发生了如下过程:H2O2→O2,则还原反应为MnO4-→Mn2+,根据质量守恒定律、电子守恒及电荷守恒可知,离子反应2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是_____________。
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式
固体B_____________;沉淀D_______________;溶液E_______________。
(3)写出①、④两个反应的化学方程式
①___________________________;④______________________________。
(4)写出②、③两个反应的离子方程式
②__________________________;③______________________________。
(5)设计实验检验溶液F中所含溶质:_________________________________________________。
(6)分别写出固体B和沉淀D在工业上的一种主要用途:
固体B:______________________;沉淀D:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是( )

A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为Mg2++2e-=Mg
C. 该电池充电时,Mg-Sb(液)层发生还原反应
D. 该电池充电时,Cl-向中下层界面处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,2NO+Na2O2====2NaNO2,以木炭、浓硝酸、Na2O2为主要原料制备亚硝酸钠的装置如图所示。(加热装置及部分夹持装置已略去)

回答下列问题:
(1)A装置中反应的化学方程式为__________________________________________。
(2)B装置的作用是_________________________________________________。
(3)充分反应后,C中生成的固体除NaNO2外,还可能生成_________(填化学式),为避免杂质的生成,应在B、C之间加一个为_________装置,该装置和所盛放试剂的名称分别是____________。
(4)检查装置气密性并装入药品后,以下实验操作步骤正确的顺序为_________( (填标号)。
a.打开弹簧夹,向装置中通入N2 b.点燃酒精灯
c.向三颈烧瓶中滴加浓硝酸 d.熄灭酒精灯
e.关闭分液漏斗旋塞 f.停止通入N2
(5)D装置用于尾气处理,写出D中反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从淡化海水中提取溴的流程如下:

下列有关说法不正确的是
A. X试剂可用Na2SO3饱和溶液
B. 步骤Ⅲ的离子反应:2Br-+Cl2=2Cl-+Br2
C. 工业上每获得1molBr2,需要消耗Cl244.8L
D. 步骤Ⅳ包含萃取、分液和蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
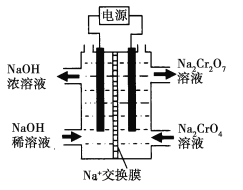
【题目】Cr2O72-、Cr3+对环境具有极强的污染性,含有Cr2O72-、Cr3+的工业废水常采用NaOH沉淀方法除去。
已知:①常温下,Cr3+完全沉淀(c≤1.0×105 mol· L1) 时,溶液的pH为5;NaOH过量时Cr(OH)3溶解生成CrO2-②Cr2O72-还原产物为Cr3+。
请回答下列问题:
(1)写出Cr(OH)3溶于NaOH的离子方程式______________________
(2)常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=___________。
(3)常温下,向50 mL 0.005 mol·L1的Cr2(SO4)3溶液中加入0.24 mol·L1的NaOH溶液50 mL,充分反应后,溶液pH为______。
(4)为了测定工业废水中Na2Cr2O7的浓度,进行如下步骤:
Ⅰ.取100 mL滤液;
Ⅱ.用c mol·L1的标准KMnO4酸性溶液滴定b mL一定浓度的FeSO4溶液,消耗KMnO4溶液b mL;
Ⅲ.取b mL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗d mL FeSO4溶液。
①步骤Ⅱ中的滴定过程应选用_______(填“酸式”或“碱式”)滴定管,滴定管装液前的操作是_______。
②步骤Ⅲ的滤液中Na2Cr2O7的含量为_______mol·L1。
(5)利用图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,Na2CrO4生成Na2Cr2O7的离子方程式_______________________。若左侧电极产生标况下2.24L的气体,则通过交换膜的钠离子的数目为___________________
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组查阅资料知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。
如图是制取溴苯的装置。试回答:

(1)装置A中发生反应的化学方程式是_________________________。
(2)装置C中看到的现象是____________________,证明________________________。
(3)装置B是吸收瓶,内盛CCl4液体,实验中观察到的现象是________,原因是____________。
如果没有B装置而将A、C直接相连,你认为是否妥当?________(填“是”或“否”),理由是______________________。
(4)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,烧杯______________(填“上”或“下”)层为溴苯,这说明溴苯______________且______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工艺流程如图:(已知TeO2微溶于水,易溶于强酸和强碱) 下列有关说法正确的是

A. “氧化浸出”时为使碲元素沉淀充分,应加入过量的硫酸
B. “过滤”用到的玻璃仪器:分液漏斗、烧杯、玻璃棒
C. “还原”时发生的离子方程式为2SO32-+Te4++4OH-=Te↓+2SO42-+2H2O
D. 判断粗碲洗净的方法:取少量最后一次洗涤液,加入BaCl2溶液,没有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,不能达到实验目的的是( )

A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸发KCl溶液制备无水KCl
C. 用图3所示装置可以完成“喷泉”实验
D. 用图4所示装置制取干燥纯净的NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com