
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4 LCC14中含CC14的分子数为NA
B.0.1 mol/L的NaOH溶液中含OH-的数目为0.INA
C.5.6 g Fe在0.1 mol Cl2中充分燃烧时转移的电子数为0.3NA
D.23 g钠在空气中充分燃烧时转移的电子数为NA
科目:高中化学 来源: 题型:
【题目】依据事实,写出反应的热化学方程式或计算反应热.
(1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放出22.5kJ热量.则该反应的热化学方程式为_____.
(2)已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=﹣880kJ/mol.
②C(s)+O2(g)═CO2(g)△H2=﹣393 kJ/mol.
③H2(g)+![]() O2(g)═H2O(l)△H3=﹣285.8kJ/mol
O2(g)═H2O(l)△H3=﹣285.8kJ/mol
则反应:C(s)+2H2(g)+CO2(g)=CH3COOH(l)△H=_____kJmol﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.1.6g由O2和O3组成的混合物中含有O原子的数目为0.1NA
B.在Na2O2与H2O的反应中,每生成0.1molO2,转移电子的数目为0.4NA
C.标准状况下,11.2L苯中含有分子的数目为0.5NA
D.常温下,0.2L0.5mol/LNH4NO3溶液中含有的N原子数小于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某NaOHmolL-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为______________;
(2)盛装标准盐酸的仪器名称为______________;
(3)滴定至终点的颜色变化为______________;
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为______________;

(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为______________; (保留四位有效数字)
实验序号 | 待测NaOH溶液的体积/mL | 0.1000molL-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
(6)下列哪些操作会使测定结果偏高_________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L的容器中,用纯净的CaCO3与100mL稀盐酸反应制取CO2,反应生成CO2的体积随时间的变化关系如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )
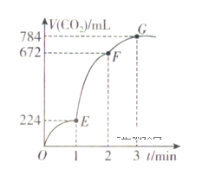
A.OE段表示的平均反应速率最快
B.G点收集到的CO2的量最多
C.EF段,用盐酸表示该反应的平均反应速率为0.04mol·L-1·min-1
D.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )
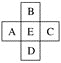
A. 4xB. 4x+14
C. 4x+10D. 4x+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同情况下测得A(g)+3B(g)![]() 2C(g)+ 2D(s)的下列反应速率,其中反应速率最大的是
2C(g)+ 2D(s)的下列反应速率,其中反应速率最大的是
A. υ(D)=0.01 molL-1s-1 B. υ(C)=0.010 molL-1s-1
C. υ(B)=0.6 molL-1min-1 D. υ(A)=0.2molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰不仅是活性好的催化剂,也被广泛用作干电池的正极材料。某化学小组设计用高硫锰矿(主要成分为锰的化合物和硫化亚铁)为原料制取二氧化锰的工艺流程如图:
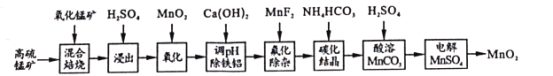
已知:①“混合焙烧”后的烧渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
②在该条件下,金属离子开始沉淀和完全沉淀的pH如下表。
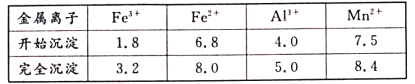
(1)写出浸出时与铝元素有关的离子反应方程式__。
(2)上述“氧化”步骤是否可省略__(填“是”或“否”),你的依据是__。
(3)“调pH除铁铝’’时,生成沉淀的pH范围为__;“氟化除杂”中除去的离子为__。
(4)请用平衡移动原理解释除杂处理后的Mn2+用NH4HCO3转化成MnCO3沉淀的过程__(用文字和离子方程式表达)。
(5)用惰性电极电解MnSO4制备MnO2时,其阳极反应式为__;整个流程中能够循环利用的物质除MnO2外还有__(写名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com