
【题目】为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
(探究一)(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是__________。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用__________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g,由此可求算气体Y中SO2的体积分数__________。
(探究二)
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893gL-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。

(3)装置B中试剂的作用是__________。
(4)分析Y气体中的Q2气体是如何生成的__________。(用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于__________(选填序号)。
a.A之前 b.A﹣B间 c.B﹣C间 d.C﹣D间
(6)如果气体Y中含有Q1,预计实验现象应是__________。
【答案】铁表面被钝化,阻止了内部金属与酸的进一步反应 d 80% 检验SO2是否除尽 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O c D中固体由黑色变红色和E中固体由白色变蓝色
CO2↑+2SO2↑+2H2O c D中固体由黑色变红色和E中固体由白色变蓝色
【解析】
(1)常温下,铁遇冷的浓硫酸发生钝化现象;
(2)①亚铁离子有还原性,能还原酸性高锰酸钾溶液而使其褪色;
②气体Y通入足量溴水中,发生SO2+Br2+2H2O═2HBr+H2SO4反应,根据硫酸钡与二氧化硫的关系式计算二氧化硫的体积,再根据体积分数公式计算;
(3)二氧化硫能使品红溶液褪色,据此判断是否含有二氧化硫;
(4)碳素钢中含有碳,加热条件下,碳和浓硫酸反应生成二氧化碳;
(5)用澄清石灰水检验二氧化碳,首先要排除二氧化硫的干扰;
(6)Q1气体,在标准状况下,密度为0.0893gL-1,其摩尔质量为0.0893gL-1×22.4Lmol-1=2gmol-1,所以Q1是氢气,氢气检验还原性,能含有氧化铜同时生成水,水能使无水硫酸铜变蓝。
(1)常温下,铁遇冷的浓硫酸发生氧化还原反应,在铁表面生成一层致密的氧化物薄膜而阻止了进一步的反应,即发生钝化现象,所以反应片刻后取出观察,铁钉表面无明显变化;
(2)①亚铁离子具有还原性,而酸性高锰酸钾有氧化性,发生氧化还原反应使高锰酸钾溶液褪色,故答案为:d;
②气体Y通入足量溴水中,发生反应,SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,离子方程式为:SO2+Cl2+2H2O=SO42-+2Cl-+4H+,SO42-+Ba2+=BaSO4↓,所以硫酸钡和二氧化硫之间的关系式为SO2~BaSO4,设二氧化硫的体积为V,

V=![]() =0.448L=448mL,所以二氧化硫的体积分数=
=0.448L=448mL,所以二氧化硫的体积分数=![]() ×100%=80%;
×100%=80%;
(3)二氧化硫能使品红溶液褪色,所以用品红溶液检验二氧化硫是否除尽;
(4)碳素钢中含有碳,加热条件下,碳能和浓硫酸反应生成二氧化硫、二氧化碳和水,反应方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(5)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,但二氧化硫还能使品红溶液褪色,所以要检验二氧化碳必须排除二氧化硫的干扰,B装置是检验二氧化硫是否除尽,所以澄清石灰水应放置在B和C之间,即在通入碱石灰之前检验,故答案为:c;
(6)Q1气体,在标准状况下,密度为0.0893gL-1,其摩尔质量为0.0893gL-1×22.4Lmol-1=2gmol-1,所以Q1是氢气,氢气具有还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色,这是检验水的特征反应,所以如果D中氧化铜变红,E中无水硫酸铜变蓝,则证明含有氢气。


科目:高中化学 来源: 题型:
【题目】I:电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为______(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的离子方程式为__________;
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是____(填标号)。
A.c(H+)>c(OH-) B.c(H+)<c(OH-)
C.c(H+)+c(HCN) = c(OH-) D.c(HCN)+ c(CN-)=0.01mol/L
(4)已知NaHCO3溶液呈碱性,原因是____(用离子方程式表示);请写出该溶液中各离子浓度的大小_____________,电荷守恒表达式_________;
II:按要求填空:
(1)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的____________。
(2)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理_______;
(3)将25℃下pH=12的NaOH溶液aL与pH=1的HCl溶液b L混合,若所得混合液为中性,则a:b=_____。(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是![]()
![]()
A. CS2是V形分子 B. SnBr2键角大于![]()
C. BF3是三角锥形分子 D. NH4+键角等于10928ˊ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素的单质和化合物在化工、医药、材料等领域有着广泛的应用。
(1)锗是重要半导体材料,基态Ge原子中,核外电子占据最高能级的符号是______,该能级的电子云轮廓图为________。Ge的晶胞结构与金刚石类似,质地硬而脆,沸点2830℃,锗晶体属于_______晶体。
(2)(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为_______,(CH3)3C+中碳骨架的几何构型为________。
(3)治疗铅中毒可滴注依地酸钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_______。
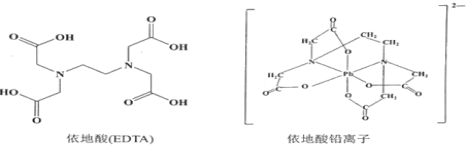
A.形成依地酸铅离子所需n(Pb2+)∶n(EDTA)=1∶4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(4)下表列出了碱土金属碳酸盐的热分解温度和阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
碱土金属碳酸盐同主族由上到下的热分解温度逐渐升高,原因是:__________。
(5)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图:
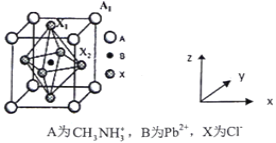
①若该晶胞的边长为anm,则Cl-间的最短距离是________。
②在该晶胞的另一种表达方式中,若图中Pb2+处于顶点位置,则Cl-处于____位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、锌及其化合物用途非常广泛。回答下列问题:
(1)O和S处于同一主族。H2O及H2S中,中心原子的杂化方式相同,键长及键角如图所示。
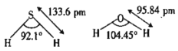
①H2O分子中的键长比H2S中的键长短,其原因是________。
②H2O分子中的键角∠HOH比H2S分子中的键角∠HSH大,其原因是________。
(2)单质硫与热的NaOH浓溶液反应的产物之一为Na2S3。S32-的空间构型为______,中心原子的杂化方式为_______。
(3)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中含有______个σ键。
②分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则噻吩分子中的大π键应表示为________。
),则噻吩分子中的大π键应表示为________。
③噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,后者沸点较高,其原因是_________。
)的沸点在129~131℃之间,后者沸点较高,其原因是_________。
(4)冰晶体的结构与金刚石的结构相似,属立方晶系。如图,将金刚石晶胞中的C原子全部置换成O原子,O原子与最近距离的四个O原子相连,H原子插入两个相连的O原子之间,与氧形成一个共价键和一个氢键,即为冰中的共价键和氢键。0℃时冰晶体中氢键的键长(定义氢键的键长为O—H…O的长度)为_____cm(列出计算式即可)。(0℃时冰密度为0.9g/cm3。)
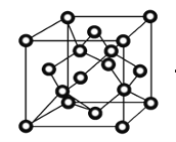
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下几种可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集该雾霾,并经必要的预处理后得试样溶液,设计并完成了如下的实验。请根据以下的实验操作与现象,判断该同学得出的结论不正确的是
已知:3NO3-+8Al+5OH-+2H2O=3NH3↑+8AlO2-

A. 试样中一定存在NH4+、Mg2+、SO42-和NO3-
B. 气体1和气体2成分一定相同
C. 试样中可能含有Al3+
D. 该雾霾中可能存在NH4NO3、NaCl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
A. ①②B. ①③C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产与人类进步紧密相联。下列有关说法不正确的是
A. 空气吹出法提取海水中溴通常使用SO2作还原剂
B. 侯氏制碱法工艺流程中利用了物质溶解度的差异
C. 合成氨采用高温、高压和催化剂主要是提高氢气平衡转化率
D. 工业用乙烯直接氧化法制环氧乙烷体现绿色化学和原子经济
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1molO2与金属Na反应,O2一定得到4NA个电子
B.18gNH4+中所含的电子数为11NA
C.1molFe与足量的Cl2反应,转移的电子数为2NA
D.1molCl2与足量的Fe反应,转移的电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com