
【题目】反应N2(g)+O2(g)=2NO(g)的能量变化如图所示:
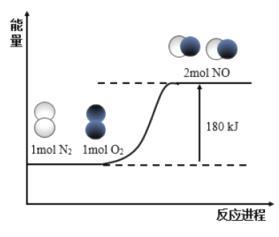
已知:断开1mol N2(g)中化学键需吸收946kJ能量,断开1mol O2(g)中化学键需吸收498kJ能量。下列说法正确的是
A.断开1mol NO(g)中化学键需要吸收632kJ能量
B.NO(g)=![]() N2(g)+
N2(g)+![]() O2(g) H=+90kJ/mol
O2(g) H=+90kJ/mol
C.N2(g)+O2(g)=2NO(g) H=-180kJ/mol
D.形成1mol NO(g)中化学键时释放90kJ能量
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】N2的结构可以表示为 ,CO的结构可以表示为
,CO的结构可以表示为 ,其中椭圆框表示 π键,下列说法不正确的是( )
,其中椭圆框表示 π键,下列说法不正确的是( )
A.N2 分子与 CO 分子中都含有三键
B.CO 分子中有一个 π 键是配位键
C.N2 与 CO 互为等电子体
D.N2 与 CO 的化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的内容正确的是( )
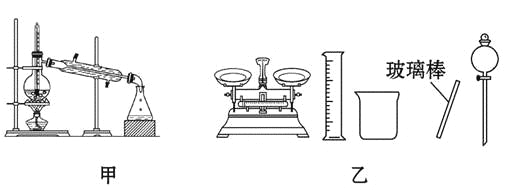
A.可用碱式滴定管量取12.85 mL的KMnO4溶液
B.实验室蒸馏石油可用如图甲所示实验装置
C.取用金属钠或钾时,没用完的钠或钾要放回原瓶
D.配制500 mL 0.4 mol/L NaCl溶液,必要的仪器如图乙所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在进行锌铜双液原电池实验时,若用铜丝代替盐桥(如图),外电路中仍然存在较小的电流,随着时间 的推移,电流逐渐减小。下列关于该装置说法错误的是
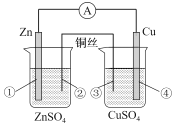
A.左池形成了原电池,Zn极的电势最高
B.铜丝②附近溶液的pH将升高
C.右池为电解池,铜丝③的反应式为 Cu-2eˉ=Cu2+
D.铜片④上有新的亮红色固体附着
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是一种有机高分子,其合成路线如下:
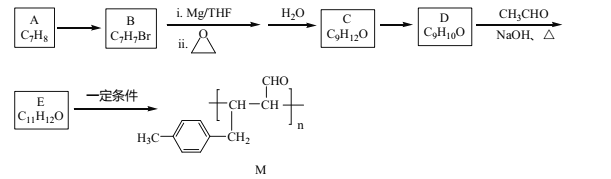
已知:①R-Br![]()
![]() R-CH2CH2OH
R-CH2CH2OH
②R-CHO![]() R-CH=CHCHO
R-CH=CHCHO
回答下列问题:
(1)A→B的反应试剂及条件是_______________。
(2)C→D的反应类型是_______________。
(3)化合物C的名称是_____________。
(4)D与银氨溶液反应的化学方程式为__________。
(5)E中官能团的名称是_______。
(6)化合物X(C10H10O)是E的同系物,且苯环上只有两个取代基,则X的同分异构体有______种,其中核磁共振氢谱为六组峰,峰面积之比为3:2:2:1:1:1的结构简式为________。
(7)设计由CH3Cl、环氧乙烷和乙醛制备CH3CH2CH=CHCHO的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)常温下为无色液体,是应用广泛的化工原料和前景乐观的燃料。
(1)已知:CH4(g)+H2O(g)CO(g)+3H2(g) H=+206.0kJ/mol-1
CH4(g)+H2O(g)CH3OH(g)+H2(g) H=+77.0kJ/mol-1
则CO和H2反应生成CH3OH(g)的热化学方程式是______________________。
(2)甲醇可用于合成3,5-二甲氧基苯酚,反应如下:
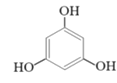 +2CH3OH
+2CH3OH![]()
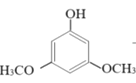 +2H2O
+2H2O
反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物。甲醇和3,5-二甲氧基苯酚的部分物理性质见表:
物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
甲醇 | 64.7 | -97.8 | 易溶于水 |
3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
①分离出甲醇的操作是______________________(填字母序号)。
a.蒸馏 b.分液 c.结晶
②洗涤时,可用于除去有机层中的氯化氢的试剂是______________________(填字母序号)。
a.Na2CO3溶液 b.NaHCO3溶液 c.NaOH溶液
(3)甲醇可用于实验室制备丙炔酸甲酯(CH![]() C—COOCH3,沸点为103~105℃)。
C—COOCH3,沸点为103~105℃)。
反应为:CH≡C—COOH+CH3OH![]() CH≡C—COOCH3+H2O
CH≡C—COOCH3+H2O
实验步骤如下:
步骤1:在反应瓶中,加入14g丙炔酸、50mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇(装置如图所示)。

步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。
①仪器A的名称是______________,蒸馏烧瓶中加入碎瓷片的目的是_______________。
②步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是______________________;分离出有机相的操作名称为_____________________。
③步骤4中,蒸馏时不能用水浴加热的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于室温下pH=2的盐酸和0.01molL-1的醋酸溶液,下列说法正确的是( )
A.两溶液中溶质的物质的量:n(CH3COOH)=n(HCl)
B.两溶液中阴离子的浓度:c(CH3COO-)<c(Cl-)
C.相同体积的两溶液均用水稀释100倍后,盐酸的pH比醋酸的大
D.相同体积的两溶液分别与足量镁条反应,盐酸产生的气体比醋酸的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上把外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液。现有25℃时,浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,已知:Ka(CH3COOH)=1.75×10-5,Kb为盐的水解常数。回答下列问题:
(1)写出CH3COONa水解的离子方程式______。
(2)该缓冲溶液中除水分子外,所有粒子浓度由大到小的顺序______。
(3)25℃时,Ka(CH3COOH)______Kb(CH3COO-)(填“>”、“<”或“=”)。
(4)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是______(填写选项字母)。
a.代谢产生的H+被HCO3-结合形成H2CO3
b.血液中的缓冲体系可抵抗大量酸、碱的影响
c.代谢产生的碱被H2CO3中和转化为HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置可确定有机物的化学式,其原理:在玻璃管内,用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
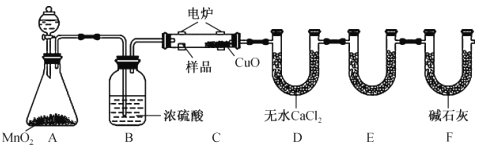
回答下列问题:
(1)装置B中的作用是____________________;若无B装置,则会造成测得的有机物中含氢量_________(填“偏大”“偏小”或“不变”)。
(2)装置E中所盛放的试剂是________ ,其作用为______________ 。
(3)若准确称取1.20g有机物(只含C、H、O 三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为_______________。
(4)要确定该有机物的分子式,还需要测定_________________ 。
(5)若该有机物的相对分子质量为60,核磁共振氢谱中有2组峰且面积比为3:1,则该有机物可能为乙酸或________ (填名称),可采取_______ 方法(填一种仪器分析法)确定该有机物具体是何种物质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com