
【题目】某“84”消毒液部分标签如下图所示,回答下列问题:
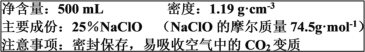
(1)NaClO变质的反应属于__________(填“氧化还原反应”或“非氧化还原反应”)
(2)计算该“84”消毒液的物质的量浓度________mol·L-1(保留小数点后一位)。
(3)某实验需用480 mL 2.0 mol·L-1NaClO的消毒液,现用NaClO固体配制。
a.需要用托盘天平称量NaClO的固体质量为________g
b.配制时,一般可分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤移液 ⑥洗涤 ⑦定容 ⑧冷却
正确的操作顺序为:____________________________________(填序号)
(4)在配制过程中,除需要烧杯、托盘天平外还必需的仪器有______________(写两种)
(5)下列操作可能使配制溶液浓度偏低的是________
A.移液时,未洗涤烧杯内壁和玻璃棒 B.溶解后未经冷却就移液
C.移液时,有少量液体溅出 D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
【答案】非氧化还原反应 4.0 74.5 ②①③⑧⑤⑥⑦④ 500mL容量瓶、胶头滴管、玻璃棒 AC
【解析】
(1)根据氧化还原反应特征进行分析;
(2)根据c=![]() 进行计算;
进行计算;
(3)配制480mL溶液需使用500mL容量瓶,根据m=cVM进行计算;配制具体操作一般为:计算→称量→溶解→冷却→移液→洗涤→定容→摇匀,据此进行分析;
(4)在配制一定物质的量浓度的溶液操作过程中,必须的仪器为:烧杯、托盘天平、500 mL 容量瓶、胶头滴管、玻璃棒,据此进行分析;
(5)根据c=![]() 进行分析。
进行分析。
(1)NaClO吸收CO2变质过程为:NaClO+CO2+H2O=HClO+NaHCO3,该过程中元素化合价均未发生变化,属于非氧化还原反应;
故答案为:非氧化还原反应;
(2)“84”消毒液的物质的量浓度=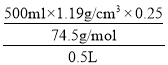 =4mol/L;
=4mol/L;
故答案为:4;
(3)配制480mL溶液需使用500mL容量瓶,因此需要称取NaClO的质量为:0.5L×2mol/L×74.5g/mol=74.5g;配制具体操作一般为:计算→称量→溶解→冷却→移液→洗涤→定容→摇匀;
故答案为:74.5;②①③⑧⑤⑥⑦④;
(4)在配制过程中,必须的仪器为:烧杯、托盘天平、500 mL 容量瓶、胶头滴管、玻璃棒;
故答案为:500 mL 容量瓶、胶头滴管、玻璃棒;
(5)A.移液时,未洗涤烧杯内壁和玻璃棒,会导致溶质未完全转移,n偏低,所配制溶液浓度偏低,故A符合题意;
B.溶解后未经冷却就移液,待溶液冷却后,溶液体积将会减小,V偏小,所配制溶液浓度偏高,故B不符合题意;
C.移液时,有少量液体溅出,会导致溶质有损失,n偏低,所配制溶液浓度偏低,故C符合题意;
D.定容时,俯视刻度线,会导致溶液实际体积偏小,所配制溶液浓度偏高,故D不符合题意;
E.容量瓶用蒸馏水洗净后,没烘干就直接使用,因定容过程中需要加入蒸馏水,因此不会影响溶液浓度,故E不符合题意;
故答案为:AC。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】某同学用右图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是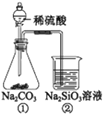
A.①和②中发生的反应均为复分解反应
B.向Na2SiO3饱和溶液中滴酚酞溶液无明显现象
C.一段时间后②中有胶冻状物质生成
D.该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
Ⅱ.(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是

A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4LO2含有的原子数为NA
B.23 g钠与O2完全反应时失去电子数目为2NA
C.标准状况下,18gH2O中含有的分子数为NA
D.标准状况下,11.2LCO2含NA个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Ti原子的价电子排布图为___________。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl。
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为_________。
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是___________。
③NH4Cl中存在的作用力有________,NH4Cl熔沸点高于CH3CH2OH的原因是________,Ti(OCH2CH3)4分子中C原子的杂化形式均为__________。
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于__________位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为__________m(列出表达式)。
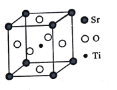
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.等体积的CO2和CO,分子数目均为NA
B.常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12NA
C.标准状况下,22.4L的H2和22.4L的F2混合后,气体分子数为2NA
D.H2O(g)通过足量Na2O2(s)充分反应,固体增重bg时,反应中转移的电子数为bNA/2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做原电池原理的实验时,有如下实验步骤:
①用导线将灵敏电流计的两端分别与纯净的锌片和铜片相连接(如图1);
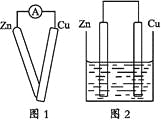
②把一块纯净的锌片插入盛有稀硫酸的烧杯中;
③把一块纯净的铜片插入盛有稀硫酸的烧杯中;
④用导线把锌片和铜片连接起来后,再平行地插入盛有稀硫酸的烧杯中(如图2)。
回答下列问题:
(1)实验步骤①中应观察到的现象是_______________________。
(2)实验步骤②中应观察到的现象是_______________________。
(3)实验步骤③中应观察到的现象是_______________________。
(4)实验步骤④中应观察到的现象是_______________________。
(5)通过实验步骤④该同学头脑中有了一个猜想(或假设),该猜想是_______。
(6)为了证实该猜想,该同学又设计了第⑤步实验,请简要画出第⑤步实验的装置示意图。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图(1)是实验室合成溴苯并检验其部分生成物的装置,下列说法错误的是( )

A.苯和液溴在A中发生的反应为取代反应
B.实验中C中的液体逐渐变为浅红色,是因为溴具有挥发性
C.D、E、F均具有防倒吸的作用,其中F不可以用图(2)所示装置代替
D.D中石蕊试液慢慢变红,E中产生浅黄色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com