
【题目】图(1)是实验室合成溴苯并检验其部分生成物的装置,下列说法错误的是( )

A.苯和液溴在A中发生的反应为取代反应
B.实验中C中的液体逐渐变为浅红色,是因为溴具有挥发性
C.D、E、F均具有防倒吸的作用,其中F不可以用图(2)所示装置代替
D.D中石蕊试液慢慢变红,E中产生浅黄色沉淀
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某“84”消毒液部分标签如下图所示,回答下列问题:
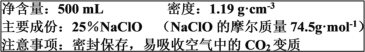
(1)NaClO变质的反应属于__________(填“氧化还原反应”或“非氧化还原反应”)
(2)计算该“84”消毒液的物质的量浓度________mol·L-1(保留小数点后一位)。
(3)某实验需用480 mL 2.0 mol·L-1NaClO的消毒液,现用NaClO固体配制。
a.需要用托盘天平称量NaClO的固体质量为________g
b.配制时,一般可分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤移液 ⑥洗涤 ⑦定容 ⑧冷却
正确的操作顺序为:____________________________________(填序号)
(4)在配制过程中,除需要烧杯、托盘天平外还必需的仪器有______________(写两种)
(5)下列操作可能使配制溶液浓度偏低的是________
A.移液时,未洗涤烧杯内壁和玻璃棒 B.溶解后未经冷却就移液
C.移液时,有少量液体溅出 D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示不正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
B.C(金刚石,s)=C(石墨,s) △H=-1.19kJ·mol-1,所以石墨比金刚石稳定
C.含1mol H2SO4的浓硫酸与足量的NaOH溶液反应,放出热量为57.3kJ
D.在101 kPa下,2 g H2 完全燃烧生成液态水放出285.8kJ热量,其热化学方程式为H2(g)+![]() O2
O2![]() H2O(l) △H=-285.8kJ·mol-1
H2O(l) △H=-285.8kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉莉花香气的成分有多种,乙酸苯甲酯(![]() )是其中的一种,它可以从茉莉花中提取,也可以用乙醇和甲苯为原料进行人工合成,其合成路线如图:
)是其中的一种,它可以从茉莉花中提取,也可以用乙醇和甲苯为原料进行人工合成,其合成路线如图:
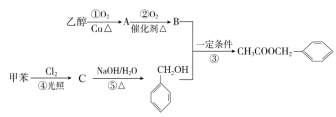
(1)C的结构简式是___,⑤的反应类型:___。
(2)A中所含官能团名称是___,以下化合物在一定条件下,能生成与A中物质相同官能团的是___(填序号),能发生消去反应生成两种烯烃的是___(填序号)
a.![]() b.
b.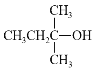 c.
c. d.
d.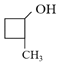
(3)①的化学方程式为___;③的化学方程式为___。
(4)乙酸苯甲酯![]() 有多种同分异构体,其中在苯环上只有一个支链,属于酯类化合物的同分异构体还有___种,其中在酸性条件下水解生成甲酸的同分异构体是:___。
有多种同分异构体,其中在苯环上只有一个支链,属于酯类化合物的同分异构体还有___种,其中在酸性条件下水解生成甲酸的同分异构体是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) △H=-452 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是
A. 1molCO 完全燃烧,放出热量为283 J
B. Na2O2(s)+CO2(s)=Na2CO3(s)+ ![]() O2(g) △H=-226 kJ·mol-l
O2(g) △H=-226 kJ·mol-l
C. CO(g) 与Na2O2(s)反应放出509kJ 热量时,电子转移数为1.204×1024
D. CO 的燃烧热为566 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复合氢化物可作为储氢和固体电解质材料,在能源与材料领域得到了深入的研究。
如:①Mg(NH2)2 ②NaNH2 ③ H3N-BH3 ④NaAlH4 ⑤Li3AlH6
(1)复合氢化物升温加热可逐步分解放出氢气,理论上单位质量的上述复合氢化物其储氢能力最低的是__________(填标号)。
(2)在Mg(NH2)2和NaNH2中均存在NH2-,NH2-的空间构型为_________,中心原子的杂化方式为____________。
(3)H3N-BH3与水反应生成一种盐和H2的化学方程式:_____________________。写出基态B原子的价电子轨道表达式:__________________________。
(4)Li3AlH6晶体的晶胞参数为a=b=801.7 pm,c=945.5 pm,α=β=90°、γ=120°,结构如图所示:
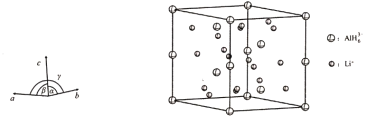
①已知AlH63-的分数坐标为(0,0,0)、(0,0,![]() ),(
),(![]() ,
,![]() ,
,![]() ),(
),(![]() ,
,![]() ,
,![]() ),(
),(![]() ,
,![]() ,
,![]() )和(
)和(![]() ,
,![]() ,
,![]() ),晶胞中Li+的个数为____________。
),晶胞中Li+的个数为____________。
②如图是上述Li3AlH6晶胞的某个截面,共含有10个AlH63-,其中6个已经画出(图中的○),请在图中用○将剩余的AlH63-画出____________。
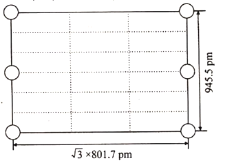
③此晶体的密度为____g·cm-3(列出计算式,已知阿伏加德罗常数约为6.02×1023mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是药物合成的一种中间体,可通过以下方法合成:
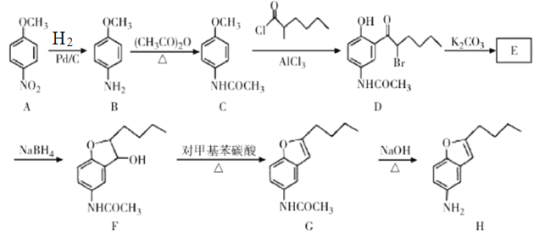
(1)B中官能团名称为____________。
(2)G→H的反应类型为____________。
(3)已知C的一种同分异构体为: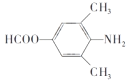 ,下列说法正确的是________。
,下列说法正确的是________。
a.能发生酯化反应
b.能发生银镜反应
c.l mol该物质完全水解产物能消耗3 mol NaOH
d.该分子的核磁共振氢谱中峰面积之比为1:2:6:2
e.其水解产物之一能与FeCl3溶液发生显色反应
(4)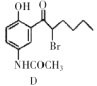 中手性碳原子个数为____________。
中手性碳原子个数为____________。
(5)E的分子是为C14H17O3N,E经还原得到F,写出E→F的反应方程式______________。
(6)已知:①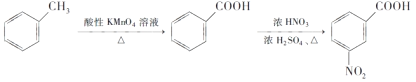
②苯胺(![]() )易被氧化
)易被氧化
请以甲苯和(CH3CO)2O为原料制备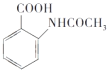 ,写出制备的合成路线流程图(无机试剂任选)______________。
,写出制备的合成路线流程图(无机试剂任选)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中正确的是( )

A.图Ⅰ所示电池中,负极电极反应为Zn-2e-![]() Zn2+
Zn2+
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com