
【题目】下列四种有机化合物的结构简式如图所示,均含有多个官能团,下列有关说法中正确的是( )
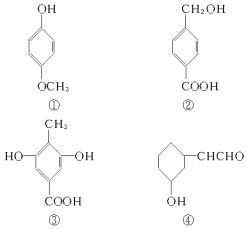
A.①属于酚类,可与NaHCO3溶液反应产生CO2
B.②属于酚类,能使FeCl3溶液显紫色
C.1mol③最多能与2molBr2发生反应
D.④属于醇类,可以发生消去反应
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)![]() qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A. X的正反应速率是Y的逆反应速率的m/n倍
B. 通入稀有气体使压强增大,平衡将正向移动
C. 降低温度,混合气体的平均相对分子质量变小
D. 增加X的物质的量,Y的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断对错(请填写“对”或“错”)
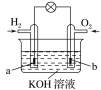
(1)具有相同核电荷数的微粒是同一种元素________
(2)不同元素组成的多原子分子里的化学键一定是极性键________
(3)最外层电子数为2的元素不一定属于主族元素________
(4)可由 2CH3OH+3O2=2CO2+4H2O 反应 ,设计成原电池________
(5)氢氧燃料电池,如图所示,a、b均为惰性电极。其中,b极为正极,电极反应是O2+4OH-+4e-=2H2O________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 a、b、c 在周期表中的位置如图所示,对于三种元素的性质比较,说法正确的是
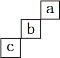
A.非金属性最强的是 a 元素
B.a、b、c 在化合物中表现化合价最高的是 c
C.气态氢化物最稳定的是 c 元素
D.最高价氧化物对应水化物的酸性最强的是 b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率可用于衡量电解质溶液导电能力的大小。向10mL 0.3 mol·L-1Ba(OH)2溶液滴入0.3 mol·L-1 NH4HSO4溶液,其电导率随滴入的NH4HSO4溶液体积的变化如图所示(忽略BaSO4溶解产生的离子)。下列说法不正确的是
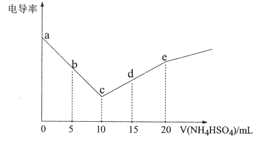
A.a→e的过程水的电离程度逐渐增大
B.b点:c(Ba2+) =0.1 moI.L-1
C.c点:c(NH4+)<c(OH-)
D.d点:c(SO42-)+c(H+)>c(OH-)+c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在化学反应中使普通分子变成活化分子所需提供的最低能量叫活化能,观察如图,然后回答问题。
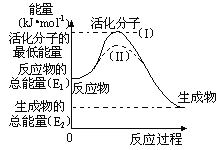
①图中反应是___(填“吸热”或“放热”),该反应的△H=___(用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJmol-1,该反应的活化能为167.2kJmol-1,则其逆反应的活化能为___。
O2(g)=H2O(g) △H=-241.8kJmol-1,该反应的活化能为167.2kJmol-1,则其逆反应的活化能为___。
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.0kJ的热量。
①反应的热化学方程式为___。
②又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是___kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法不正确的是
A. 向![]() 溶液中通入
溶液中通入![]() ,
,![]() 减小
减小
B. 将![]() 的
的![]() 溶液从
溶液从![]() 升温至
升温至![]() ,
,![]() 增大
增大
C. 向![]() 的HF溶液中滴加NaOH溶液至中性,
的HF溶液中滴加NaOH溶液至中性,![]() =1
=1
D. 向![]() 的
的![]() 溶液中加入少量水,
溶液中加入少量水,![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是

A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)=2NO2(g),在其他条件相同时,测得实验数据如下表:
压强/(×105Pa) | 温度/℃ | NO达到所列转化率需要时间/s | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
根据表中数据,下列说法正确的是
A. 升高温度,反应速率加快
B. 增大压强,反应速率变慢
C. 在1.0×105Pa、90℃条件下,当转化率为98%时的反应已达到平衡
D. 若进入反应塔的混合气体为amol,反应速率以v=△n/△t表示,则在8.0×105Pa、30℃条件下转化率从50%增至90%时段NO的反应速率为4a/370mol/s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com