
【题目】工业上,以钛铁矿(主要含FeTiO3,还含有Fe2O3 和Al2O3、SiO2等杂质)为原料制备二氧化钛并得到副产品绿矾(FeSO4·7H2O)的工艺流程如下图所示。
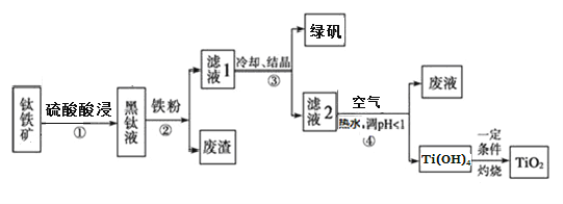
已知:TiO2+在一定条件下会发生水解。
回答下列问题:
(1)要提高酸浸时钛矿石的溶解速率,可行的措施是(写一条即可)_______________。黑钛液中生成的主要阳离子有TiO2+和Fe2+,步骤①主要反应的化学方程式是_________。
(2)步骤②中,加入铁粉的主要作用是_____,同时也会将部分TiO2+还原为Ti3+。
(3)向滤液2中通入空气的目的是______(用离子方程式表示)。
(4)请结合化学用语用化学平衡理论解释步骤④中加入热水稀释将TiO2+转化为Ti(OH)4 的原因:_________________。
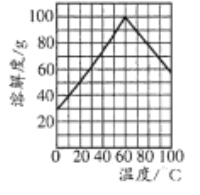
(5)副产品绿矾中含有杂质[Al2(SO4)3]。要将副产品进一步提纯,请结合右图的绿矾溶解度曲线完成提纯过程:将副产品溶于稀硫酸中,充分搅拌后,用NaOH溶液调节反应液的pH约为5,过滤沉淀后得到FeSO4溶液,______,过滤,用冰水洗涤,低温干燥,得到FeSO4·7H20晶体。
(6)用氧化还原滴定法测定制备得到的产品中TiO2的质量分数:在一定条件下,将一定量的产品溶解并将TiO2还原为Ti3+,再以KSCN溶液作为指示剂,用硫酸铁铵[NH4Fe(SO4)2]标准溶液滴定Ti3+至全部生成Ti4+。
①滴定终点的现象是_______________。
②滴定分析时,称取TiO2试样0.2 g,消耗0.1 mol/L NH4Fe(SO4)2标准溶液24.00mL,则TiO2的质量分数为_______________。
【答案】粉碎矿石或加热反应物或及时搅拌等 FeTiO3+2H2SO4![]() FeSO4+TiOSO4+2H2O 将Fe3+转化为Fe2+并防止Fe2+被氧化 4Ti3++ O2 + 2H2O
FeSO4+TiOSO4+2H2O 将Fe3+转化为Fe2+并防止Fe2+被氧化 4Ti3++ O2 + 2H2O![]() 4TiO2+ + 4H+ TiO2+在溶液中水解:TiO2+ + 3H2O
4TiO2+ + 4H+ TiO2+在溶液中水解:TiO2+ + 3H2O ![]() Ti(OH)4 + 2H+ △H>0,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4 加热浓缩得到60℃的饱和溶液,再冷却至室温(或0℃)结晶 滴入最后滴标准溶液时, 锥形瓶内溶液变成红色, 且半分钟不褪色 96%
Ti(OH)4 + 2H+ △H>0,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4 加热浓缩得到60℃的饱和溶液,再冷却至室温(或0℃)结晶 滴入最后滴标准溶液时, 锥形瓶内溶液变成红色, 且半分钟不褪色 96%
【解析】
(1)要提高酸浸时钛矿石的溶解速率,可增大接触面积、加热或加快搅拌;黑钛液中生成的主要阳离子有TiO2+和Fe2+,他们的存在形式是TiOSO4和FeSO4,反应的化学方程式是:FeTiO3+2H2SO4![]() FeSO4+TiOSO4+2H2O;
FeSO4+TiOSO4+2H2O;
(2)由(1)可知黑钛液中生成的主要阳离子有TiO2+和Fe2+,加入铁粉的目的除了可将部分TiO2+还原为Ti3+之外,还可将Fe3+转化为Fe2+并防止Fe2+被氧化;
(3)向滤液2中通入空气,可将三价的钛离子氧化成TiO2+,用离子方程式表示为:4Ti3++ O2 + 2H2O=4TiO2+ + 4H+
(4)TiO2+在一定条件下会发生水解生成Ti(OH)4和氢离子,溶液中存在平衡:TiO2++3H2O![]() Ti(OH)4+2H+,△H>0,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4;
Ti(OH)4+2H+,△H>0,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4;
(5)根据金属离子沉淀的pH值,通过滴加NaOH溶液调节pH至5.0把Al3+除去,过滤,即得到FeSO4溶液,加热浓缩得到60℃饱和溶液,然后放在冰水中冷却至室温,冷却结晶,后过滤,洗涤,低温干燥,得到FeSO4·7H20晶体;
(6)①TiO2中Ti的化合价由+4价→+3价,化合价降低,把Fe2+氧化成Fe3+,Fe3+与KSCN溶液,溶液变红,即滴定到终点的现象是:滴入最后一滴标准溶液时, 锥形瓶内溶液变成红色, 且半分钟不褪色;③依据得失电子数目守恒,有:n(Fe2+)×1=n(TiO2)×1,即n(TiO2)=n(Fe2+)=24×10-3×0.1mol=2.4×10-3mol,其质量分数为2.4×10-3×80/0.2×100%=96%;


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 按系统命名法,![]() 的名称为2,4,5-三甲基己烷
的名称为2,4,5-三甲基己烷
B. 3-甲基-3-乙基戊烷的一氯取代产物有6种
C. 化合物![]() 是苯的同系物
是苯的同系物
D. 分子![]() 中,位于同一平面上碳原子最多有6个
中,位于同一平面上碳原子最多有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习。下列物质的分类不正确的是
A.SO2(氧化物)B.碘酒(单质)C.HNO3(含氧酸)D.氯水(混合物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下6种为中学化学中常见的物质:①Cu、②NaHSO4、③SO3、④H2SO4、⑤CaCO3、⑥Cu(OH)2;其中属于电解质的是__(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J 是我国自主成功研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:
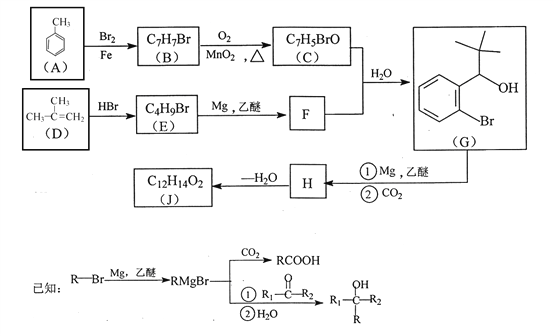
回答下列问题:
(1)B的结构简式是________________。C的结构简式是______________。
(2)D生成 E的化学方程式为_________________。
(3)J的结构简式是________________。在一定条件下,H自身缩聚生成高分子化合物的结构简式是_______________。
(4)根据![]() ,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无一O—O—键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以甲烷和甲苯 为原料,合成![]() 的路线流程图(其它试剂自选):____________________________。
的路线流程图(其它试剂自选):____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球热播影片《阿凡达》于2010年1月4日在中国内地上映,影片中出现了一种潘多拉星球的宇宙飞船。下表是元素周期表中的一部分,表中所列字母分别表示一种元素。(选项中的物质都由下表中的元素组成)

由以上信息可推断下列说法正确的是
A. 宇航员在宇宙飞船活动舱内会产生由d和f组成的气体,吸收这种气体的化合物应该由e和f组成
B. 活动舱内还要营造一种适合宇航员生存的人工生态环境,即充入a和f的常见单质
C. c和f以原子个数之比为1∶1组成的化合物可用作宇航员所需f单质的来源
D. 若潘多拉星球上存在![]() ,地球上此元素主要以
,地球上此元素主要以![]() 形式存在,
形式存在,![]() 比
比![]() 少一个质子
少一个质子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,重水(D2O)的离子积为1.6×10-15,也可用pH值一样的定义来规定其酸碱度:pD=-lg[D+],下列有关pD的叙述正确的是( )
①中性D2O的pD=7
②在1LD2O中,溶解0.01molNaOD,其pD值为12
③1L0.01mol/L的DCl的重水溶液,pD=2
④在100mL0.25mol/LDCl的重水溶液中,加入50mL0.2mol/LNaOD的重水溶液,反应后溶液的pD=1.
A. ①②B. ③④C. ②③D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com