
【题目】下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是( )

A.装置A:实验室制乙烯
B.装置B:实验室制乙炔并验证乙炔能发生氧化反应
C.装置C:实验室中分馏石油
D.装置D:若 A 为醋酸,B 为贝壳(粉状),C 为苯酚钠溶液,可验证醋酸酸性强于碳酸,但不能验证碳酸酸性强于苯酚
科目:高中化学 来源: 题型:
【题目】已知某浓度的硫酸在水中的电离方程式:
H2SO4=H++HSO4-,HSO4-![]() H++ SO42-。
H++ SO42-。
(1)Na2SO4溶液显__________(填“酸性”“碱性”或“中性”),理由是(用离子方程式表示)_________。
(2)在25 ℃时0.1 mol·L-1的NaHSO4溶液中c(SO42-)=0.029 mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c(SO42-)_________0.029 mol ·L-1(填“大于”,“小于”或“等于”),理由是 。
(3)在0.1 mol ·L-1 Na2SO4溶液中,下列粒子浓度关系正确的是 。
A.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
B.2c(Na+)=c(SO42-)+c(HSO4-)
C.c(Na+)>c(SO42-)>c(H+)>c(OH-)
D.c(SO42-)+c(HSO4-)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤尾气是造成空气污染的重要原因之一,治理汽车尾气和燃煤尾气是环境保护的重要课题。回答下列问题:
(1)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
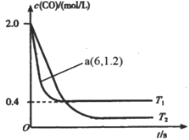
①据此判断该反应的正反应为________(填“放热”或“吸热”)反应。
②温度T1时,该反应的平衡常数K=_____;反应速率v=v正- v逆=k正c2(NO)c2(CO)-k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处![]() =________。
=________。
(2)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素作还原剂,其基本流程如图:
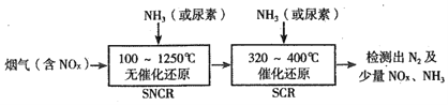
①SNCR-SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0,则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为______________。
②体系温度直接影响SNCR技术的脱硝效率,如图所示:

SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是__________;当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萘、四氢萘、十氢萘用途广泛,其转化关系为: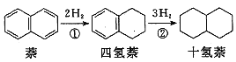 ,该过程中能量变化如图所示,下列说法不正确的是:( )
,该过程中能量变化如图所示,下列说法不正确的是:( )

A.萘分子(![]() )的一氯代物有2种
)的一氯代物有2种
B.E1、E2表示活化能,a的大小由E1决定,b的大小由E2决定
C.实线表示无催化剂的反应过程,虚线表示有催化剂的反应过程
D.物质的稳定性:十氢萘>四氢萘>萘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将AgCl分别加入盛有:①5 mL水;② 6 mL0.5mol·L-1 NaCl溶液;③10 mL0.2mol·L-1 CaCl2溶液;④50 mL0.1mol·L-1盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
A. ④③②① B. ②③④① C. ①④③② D. ①③②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是( )

A. 可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
B. 1mol该有机物与NaOH溶液反应,最多消耗3mol NaOH
C. 分枝酸的分子式为C10H8O6
D. 分枝酸分子中含有2种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】求下列溶液的pH(常温条件下)(已知lg2=0.3)
(1)0.005 mol·L-1的H2SO4溶液________
(2)已知CH3COOH的电离常数Ka=1.8×10-5,0.1 mol·L-1的CH3COOH溶液________
(3)0.1 mol·L-1NH3·H2O溶液(NH3·H2O的电离度为α=1%,电离度=![]() ×100%)________
×100%)________
(4)将pH=8的NaOH与pH=10的NaOH溶液等体积混合________
(5)常温下,将pH=5的盐酸与pH=9的NaOH溶液以体积比11∶9混合________
(6)将pH=3的HCl与pH=3的H2SO4等体积混合________
(7)0.001 mol·L-1的NaOH溶液________
(8)pH=2的盐酸与等体积的水混合________
(9)pH=2的盐酸加水稀释到1 000倍________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F具有独特的生理药理作用,实验室由芳香化合物A制备F的一种合成路线如下:

已知:①R—Br![]() R—OCH3
R—OCH3
②R—CHO+
![]() R—CH=CH—COOH
R—CH=CH—COOH
回答下列问题。
(1)A的名称为___,B生成C的反应类型为___。
(2)咖啡酸的结构简式为___。
(3)写出F与足量NaOH溶液反应的化学方程式:___。
(4)G为香兰素的同分异构体,能使FeCl3溶液变紫色,苯环上只有两个取代基团,能发生水解反应,符合要求的同分异构体有___种,请写出其中任意一种核磁共振氢谱图显示有4种不同环境的氢,峰面积比为3∶2∶2∶1的G的结构简式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程中的能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。
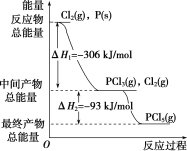
根据如图回答下列问题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式是________________________________________________________。
(2)PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式是_____________________。
(3)P(s)和Cl2(g)分两步反应生成1 mol PCl5(g)的ΔH3=____,P(s)和Cl2(g)一步反应生成1 mol PCl5(g)的ΔH4____(填“大于”“小于”或“等于”)ΔH3。
(4)已知1mol白磷变成1mol红磷放出18.39KJ的热量和下列两个热化学方程式:
4P(白磷,s)+5O2(g)=2P2O5(s) ΔH1,
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2。
则ΔH1和ΔH2的关系正确的是(______)
A.ΔH1=ΔH2 B.ΔH1>ΔH2 C.ΔH1<ΔH2 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com