
| ||

| 实验步骤(不要写出具体操作过程) | 预期实验现象与结论 |
| 160 |
| 16.0g |
| x |
| 16.0g-14.4g |


科目:高中化学 来源: 题型:
| A、n-m | ||
B、
| ||
C、
| ||
| D、无法求得 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据溶液中的金属离子和残留固体的成分最多会有5种情况 |
| B、若金属有剩余,在溶液中再滴入稀硫酸后,金属不会溶解 |
| C、当合金刚好溶解时,在标准状况下产生2.24LNO |
| D、若合金全部溶解,在溶液中加入过量的氨水,(已知铜离子可转化为四氨合铜络离子溶于水)则经过滤、洗涤、干燥、充分灼烧、称量可得固体4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
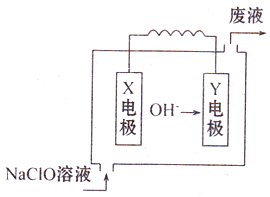 如图为Mg-NaClO燃料电池结构示意图.已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极.
如图为Mg-NaClO燃料电池结构示意图.已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用肉眼观察区别溶液、胶体和浊液 |
| B、用BaCl2溶液鉴别Na2SO3是否变质 |
| C、用澄清石灰水鉴别Na2CO2溶液和NaHCO3溶液 |
| D、用NaOH除去Mg中混有的少量Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示.
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
序号 | 待测溶液体积(单位:mL) | 所消耗盐酸体积(单位:mL) | ||
| 滴定前 读数 | 滴定后 读数 | 消耗盐酸体积 | ||
| 1 | 20.00 | 0.50 | 20.60 | V(平)= |
| 2 | 20.00 | 6.00 | 26.00 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
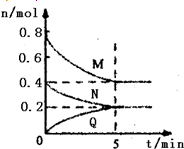 在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g)?cQ(g).气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g)?cQ(g).气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )A、该温度下此反应的平衡常数的值K=
| ||
| B、平衡时,M的转化率为50%,若条件改为恒温恒压,则达平衡时M的转化率小于50% | ||
| C、若开始时向容器中充入2mol M和1mol N,达到平衡时,M的体积分数小于50% | ||
| D、在5 min时,再向体系中充入少量He,重新达到平衡前v(正)>v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com