
【题目】用化学原理和相应的方程式解释生活中的现象。
(1) 碳酸钙高温分解生成氧化钙和二氧化碳的化学反应中,![]() S______0;
S______0;
(2)明矾水溶液的pH_______7, 请用离子方程式说明原因______;
(3)盐碱地(含有氯化钠,碳酸钠)不利于作物生长。通过施加适量石膏可以降低土壤碱性。试用水解方程式分别表示盐碱地产生碱性的原因______________;以及用石膏降低其碱性的反应原理______________;
(4)请写出硫酸钡的溶解平衡方程式______________;并说明为什么在洗涤硫酸钡沉淀时,采用0.010mol/L的硫酸进行洗涤______________
【答案】> pH<7 Al3++3H2OAl(OH)3↓+3H+ CO32-+H2OHCO3-+OH- 石膏是水合硫酸钙, CaSO4+CO32-CaCO3+SO42-,产生固体碳酸钙,降低其碱性 BaSO4Ba2++SO42- 溶解平衡为可逆反应,加入硫酸时增大了硫酸浓度,平衡逆向移动,抑制了固体的溶解
【解析】
根据反应,固体碳酸钙产生气体二氧化碳和氧化钙固体,体系混乱度增多,熵变增大;明矾中铝离子发生水解;碳酸钠是强碱弱酸盐,农业上根据沉淀平衡进行中性处理。
(1) 混乱度越大,熵越大,故碳酸钙高温分解生成氧化钙和二氧化碳的化学反应中,![]() S>0;
S>0;
(2)明矾在水溶液中电离出铝离子,发生水解产生氢离子,Al3++3H2OAl(OH)3↓+3H+,明矾水溶液的pH<7;
(3)盐碱地含有氯化钠、碳酸钠,碳酸钠是强碱弱酸盐,碳酸根发生水解产生氢氧根离子,CO32-+H2OHCO3-+OH-,故盐碱地显碱性;石膏是水合硫酸钙,根据沉淀平衡CaSO4+CO32-CaCO3+SO42-,产生固体碳酸钙,降低其碱性;
(4)硫酸钡的溶解平衡方程式BaSO4Ba2++SO42-;溶解平衡为可逆反应,加入硫酸时增大了硫酸浓度,平衡逆向移动,抑制了固体的溶解。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,A的简单离子焰色反应为黄色。B的最高价氧化物对应水化物B(OH)2 5.8 g恰好能与100 mL 2 mol·L-1盐酸完全反应;且B原子核中质子数和中子数相等。E2在黄绿色气体C2中燃烧产生苍白色火焰。D原子的最外层电子数是次外层电子数的3倍,F和D同主族。 根据上述条件回答:
(1)写出元素B的名称 ,元素C在元素周期表中的位置 。
(2)A、D形成淡黄色化合物,该物质中含有的化学键类型为 。
(3)C2与ADE溶液反应的离子方程式为 。
(4)用电子式表示BC2的形成过程 。
(5)由元素D和E构成的9e-微粒名称是 。
(6)比较元素C和F的气态氢化物的稳定性 > (用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH 溶液在图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。下列说法正确的是( )

A. 实验过程中没有热量损失
B. 烧杯间填满碎纸条的作用是固定小烧杯
C. 图中实验装置缺少环形玻璃搅拌棒
D. 若将盐酸体积改为60 mL,理论上所求中和热不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种正投入生产的大型蓄电系统如图所示。放电前,被交换膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述不正确的是

A. 放电时,负极的电极反应式为2S22――2e-===S42-
B. 充电时,阳极的电极反应式为3Br--2e-===Br3-
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 充电时,M接电源负极,N接电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:

已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)A的名称是______;B中所含官能团的名称是______。
(2)反应⑤的化学方程式为______,该反应的反应类型是______。
(3)G的分子式为______。
(4)写出满足下列条件的E的同分异构体的结构简式:______、______。
Ⅰ.苯环上只有三个取代基
Ⅱ核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备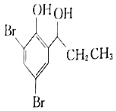 的合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种常用金属,冶炼方法有火法和湿法。回答下列问题:
I. 镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga在元素周期表中的位置为_______________。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为_______________。
(3)下列有关镓和镓的化合物的说法正确的是_____________(填字母)。
A. 一定条件下,Ga可溶于盐酸和氢氧化钠溶液
B. 常温下,Ga可与水剧烈反应放出氢气
C. Ga2O3可由Ga(OH)3受热分解得到
D. 一定条件下,Ga2O3可与NaOH反应生成盐
II. 工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示。
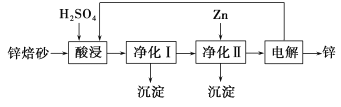
已知:Fe的活泼性强于Ni。
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式___________________。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,仅使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________________________。
(6)净化II中加入Zn的目的是_______________________________________。
III. (7)某化学课外小组拟用废旧电池锌皮(含杂质铁),结合如图所示信息,从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。

实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1的稀硫酸,加入_______(选填字母,下同);
A. 30%H2O2 B. 新制氯水
C. FeCl3溶液 D. KSCN溶液
②加入__________;
A. 纯锌粉 B. 纯碳酸钙粉末
C. 纯ZnO粉末 D. 3mol·L-1的稀硫酸
③加热到60℃左右并不断搅拌;
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本的元素之一。按要求回答:
(1)碳原子核外有________种不同空间运动状态的电子,第一电离能介于B和C之间的元素的名称为_________。
(2)碳元素能形成多种无机物。
①CO32-的立体构型是_______________。
②MgCO3分解温度比CaCO3低的原因是_________________________。
③石墨与钾可形成石墨夹层离子晶体C8K(如图),其结构为每隔一层碳原子插入一层钾原子,与钾原子层相邻的上下两层碳原子排列方式相同,则与钾最近等距的配位碳原子有_________个。

(3)碳也可形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。

①1 mol 吡啶分子中含有σ键数目是__________。
②嘌呤结构中N原子的杂化方式为________。
③嘌呤中轨道之间的夹角∠1比∠2大,解释原因________________________________。
(4)将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代可形成碳的一种新型三维立方晶体结构——T-碳。已知T-碳密度为ρ g/cm,阿伏加德罗常数为NA,则T-碳的晶胞参数a=________ pm (写出表达式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是( )

A. ①②③ B. ③②① C. ②①③ D. ①③②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com