
【题目】锌是一种常用金属,冶炼方法有火法和湿法。回答下列问题:
I. 镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga在元素周期表中的位置为_______________。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为_______________。
(3)下列有关镓和镓的化合物的说法正确的是_____________(填字母)。
A. 一定条件下,Ga可溶于盐酸和氢氧化钠溶液
B. 常温下,Ga可与水剧烈反应放出氢气
C. Ga2O3可由Ga(OH)3受热分解得到
D. 一定条件下,Ga2O3可与NaOH反应生成盐
II. 工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示。
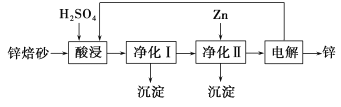
已知:Fe的活泼性强于Ni。
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式___________________。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,仅使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________________________。
(6)净化II中加入Zn的目的是_______________________________________。
III. (7)某化学课外小组拟用废旧电池锌皮(含杂质铁),结合如图所示信息,从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。

实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1的稀硫酸,加入_______(选填字母,下同);
A. 30%H2O2 B. 新制氯水
C. FeCl3溶液 D. KSCN溶液
②加入__________;
A. 纯锌粉 B. 纯碳酸钙粉末
C. 纯ZnO粉末 D. 3mol·L-1的稀硫酸
③加热到60℃左右并不断搅拌;
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是________________________________。
【答案】第四周期IIIA族 2Ga+2NH3![]() 2GaN+3H2 ACD ZnFe2O4+4H2SO4 ==== ZnSO4+Fe2(SO4)3+4H2O Fe(OH)3胶粒具有吸附性 使Cu2+、Ni2+转化为Cu、Ni而除去 A C 促进Fe3+水解转化为沉淀,并使过量的H2O2分解除去
2GaN+3H2 ACD ZnFe2O4+4H2SO4 ==== ZnSO4+Fe2(SO4)3+4H2O Fe(OH)3胶粒具有吸附性 使Cu2+、Ni2+转化为Cu、Ni而除去 A C 促进Fe3+水解转化为沉淀,并使过量的H2O2分解除去
【解析】
Ⅰ(1)Ga的原子序数为31,位于第四周期第ⅢA族;
(2)Ga和NH3在高温条件下反应生成GaN和氢气,反应为2Ga+2NH3![]() 2GaN+3H2
2GaN+3H2
(3)镓与铝同主族且相邻,化学性质与铝相似,则
A、Al与盐酸、NaOH均反应,则一定条件下,Ga可溶于盐酸和氢氧化钠,故A正确;
B、Al与水常温不反应,则常温下,Ga不能与水剧烈反应放出氢气,故B错误;
C、氧化铝可由氢氧化铝分解生成,则Ga2O3可由Ga(OH)3受热分解得到,故C正确;
D、氧化铝与NaOH反应生成盐,则一定条件下,Ga2O3可与NaOH反应生成盐,故D正确;
故答案为:ACD;
Ⅱ(4)根据信息,酸浸时ZnFe2O4会生成两种盐,这两种盐分别为硫酸锌、硫酸铁,即ZnFe2O4与硫酸反应生成硫酸锌、硫酸铁,反应的化学方程式为:ZnFe2O4+4H2SO4=ZnSO4+Fe2(SO4)3+4H2O;
(5)因为生成的Fe(OH)3胶粒具有吸附性,能净化I生成的沉淀中还含有溶液中的悬浮杂质;
(6)CaO、FeO、CuO、NiO等氧化物溶于酸转化为金属离子,净化I后除去Fe元素,净化II中加入Zn的目的是使Cu2+、Ni2+转化为Cu、Ni而除去;
(7)据题意用废旧干电池锌皮(含杂质铁)制取纯净的ZnSO4溶液实验流程为用硫酸酸溶、除杂。由实验步骤①将锌片完全溶于稍过量的3 mol·L-1稀硫酸发生的反应为Zn + 2H+= Zn2++ H2↑、Fe + 2H+=Fe2++ H2↑,所得溶液中含有杂质离子Fe2+,必须将其除去,结合图像所给信息Zn2+和Fe2+难以分离,必须先将Fe2+氧化为Fe3+再进行分离,为不引进新的杂质,选用30%H2O2作氧化剂;
(8)分离Zn2+和Fe3+的方法结合图像可用盐类水解原理通过调节pH的方法进行除杂,为防止引进杂质可用纯ZnO粉末来调节pH,使Fe3+转化为Fe(OH)3沉淀而除去;
(9)因盐类水解吸热,H2O2受热易分解,所以步骤③加热的主要目的有促进Fe3+水解转化为沉淀并使过量的H2O2分解除去。


科目:高中化学 来源: 题型:
【题目】在容积为2 L的恒容密闭容器中,加入1 mol A(g)、2 mol B(g)发生如下反应:A(g)+2B(g)![]() C(g)+D(g)。在不同温度下,D的物质的量n(D)和时间t的关系如下图所示。
C(g)+D(g)。在不同温度下,D的物质的量n(D)和时间t的关系如下图所示。

试回答下列问题:
(1)温度为T1℃时,0~5 min内,以B表示的平均反应速率为________。
(2)T1℃________(填“<”或“>”)T2℃,该反应的正反应是________(填“放热”或“吸热”)反应。
(3)T1℃时,向上述平衡体系中再充入1 mol A、2 mol B,达到平衡时,D的物质的量n(D)________(填“>”、“<”或“=”)1.2 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)浙江大学用甲醇、CO、O2在常压、某温度和催化剂的条件下合成碳酸二甲酯(CH3OCOOCH3)的研究开发。已知:
①1mol CO完全燃烧放出283.0kJ的热量;
②1mol H2O(l)完全蒸发变成H2O(g)需吸收44.0 kJ的热量;
③2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) ΔH=-15.5 kJ·mol-1
CH3OCOOCH3(g)+H2O(g) ΔH=-15.5 kJ·mol-1
则2CH3OH(g)+CO(g)+1/2O2(g)![]() CH3OCOOCH3(g)+H2O(l) ΔH=__________。
CH3OCOOCH3(g)+H2O(l) ΔH=__________。
(2)工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压并且需要合适的催化剂。已知形成1mol H—H键、1mol N—H键、1mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压并且需要合适的催化剂。已知形成1mol H—H键、1mol N—H键、1mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
①若1 mol氮气完全反应生成氨气可放出的能量为__________kJ。
②如果将1 mol氮气和3 mol氢气混合,使充分反应,反应放出的能量总小于上述数值,为什么?__________。
③实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10分钟后,生成10 mol 氨气,则用氮气表示的化学反应速率是__________mol·L-1·min-1。
④一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是__________。
a.以同一物质表示的正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.氮气的转化率达到最大值
d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学原理和相应的方程式解释生活中的现象。
(1) 碳酸钙高温分解生成氧化钙和二氧化碳的化学反应中,![]() S______0;
S______0;
(2)明矾水溶液的pH_______7, 请用离子方程式说明原因______;
(3)盐碱地(含有氯化钠,碳酸钠)不利于作物生长。通过施加适量石膏可以降低土壤碱性。试用水解方程式分别表示盐碱地产生碱性的原因______________;以及用石膏降低其碱性的反应原理______________;
(4)请写出硫酸钡的溶解平衡方程式______________;并说明为什么在洗涤硫酸钡沉淀时,采用0.010mol/L的硫酸进行洗涤______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、也不会在空气中燃烧的气体,但能使带火星的木条复燃。

(1)A是________。
(2)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是_______________________。
(3)若C是一种黑色粉末,则B物质是________,C物质的作用是__________________。
(4)洗气瓶(广口瓶)中装的试剂D是________,其作用是_______。所制得的气体用________法收集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像与对应叙述相符合的是

A. 图甲表示某可逆反应物质的浓度随时间的变化,且在t时刻达到平衡状态
B. 图乙表示向CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C. 图丙表明合成氨反应时放热反应,b表示在反应体系中加入了催化剂
D. 图丁表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是化工和印染等行业的重要原料,广泛用作有机合成的催化剂。
Ⅰ.甲采用CuCl2·2H2O热分解法制备CuCl,装置如图。

(1)仪器X的名称是_______________,C中烧杯的试剂可以是__________。
(2)“气体入口”通入的气体是_______。
(3)反应结束后,取所得产品分析,发现其中含有氧化铜,其可能原因是______________。
Ⅱ.乙另取纯净CuCl2固体用如下方法制备CuCl。

(4)操作②中反应的离子方程式为___________________。
(5)操作①中若用100 mL 10 mol/L盐酸代替0.2 mol/L盐酸,再通入SO2后,无白色沉淀产生。对此现象有如下两种猜想:
猜想一:c(H+)过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、100 mL0.2 mol/L盐酸及________mL10.0mol/LH2SO4配制成200 mL溶液,再进行操作②,观察是否有白色沉淀产生。
猜想二:_______________。请设计实验说明该猜想是否成立:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液。
(1)写出0.1 mol·L-1一元弱酸HA的电离方程式___________________。
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为_____________________。
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为___________________;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是_________________。
①c(H+) ②n(A-) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA)
(5)实验室在配制溶液时,一些物质存在水解的情况,在配制Fe2(SO4)3溶液时,Fe3+也存在水解,请书写水解离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理来解释的是
A. 用排饱和食盐水的方法收集氯气
B. 加入催化剂使N2和H2在一定条件下生成氨气
C. 增大压强,有利于SO2和O2反应生成SO3
D. 在Fe3+ + 3SCN- ![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com