
| A、N2 |
| B、N2O |
| C、NO |
| D、NO2 |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
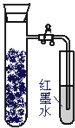 如图,向还原铁粉中加入少量的炭粉,混合均匀后,撒入内壁用NaCl溶液润湿过的具支试管中,塞紧橡皮塞.几分钟后,打开止水夹,观察到导管中水柱上升.对此过程所作的分析正确的是( )
如图,向还原铁粉中加入少量的炭粉,混合均匀后,撒入内壁用NaCl溶液润湿过的具支试管中,塞紧橡皮塞.几分钟后,打开止水夹,观察到导管中水柱上升.对此过程所作的分析正确的是( )| A、碳粉在电化学腐蚀过程中作负极 |
| B、炭粉被氧化 |
| C、发生了吸氧腐蚀 |
| D、发生了析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2是电解质,其水溶液能导电 |
| B、酸式盐的水溶液一定呈酸性 |
| C、常温时水电离出的c(H+)=10-4mol/L的溶液,不可能是稀盐酸 |
| D、常温时纯水的电离平衡常数为1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度( T ) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、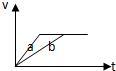 |
B、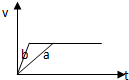 |
C、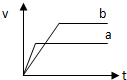 |
D、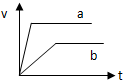 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3+2HCl═CaCl2+CO2↑+H2O | ||||
| B、CO2+H2O═H2CO3 | ||||
C、2H2O2
| ||||
D、CaCO3
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaClO3在反应中化合价降低,得到电子,被氧化 |
| B、当反应有1mol电子转移时消耗SO2的体积为11.2L |
| C、2mol氧化剂在反应中得到2mol电子 |
| D、ClO2 是氧化产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com