
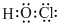 ;
;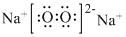 ,过氧化钠中含有的化学键为离子键和非极性键,
,过氧化钠中含有的化学键为离子键和非极性键,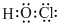 ;
;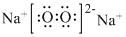 ;离子键、非极性键;
;离子键、非极性键;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Z | M | R | Q | ||
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
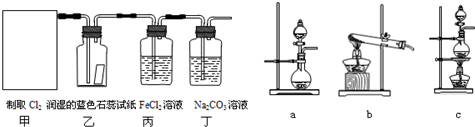
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷 | B、乙烯 | C、丁烷 | D、苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、M的分子式为C6H12O6 |
| B、N的结构简式为CH3COOH |
| C、M可以发生水解反应 |
| D、乙酸乙酯和N均能和NaOH溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
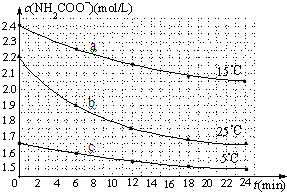 某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.
某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
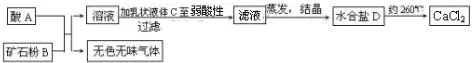
科目:高中化学 来源: 题型:
 某化工厂用氯气与氢氧化钙生产漂白粉.该厂出厂产品说明书如图所示:
某化工厂用氯气与氢氧化钙生产漂白粉.该厂出厂产品说明书如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com