
【题目】下列关32He的说法正确的是( )
A. 32He原子核内含有2个中子 B. 32He原子核内含有3个质子
C. 32He原子核外有3个电子 D. 32He和42He是两种不同的核素
科目:高中化学 来源: 题型:
【题目】将一定量Cl2通入NaOH溶液中,发现溶液中的NaOH完全被消耗,溶液中大量存在的阴离子只有Cl-、ClO-、ClO3-,则溶液中所有阴离子与所有阳离子的物质的量之比为
A.1:3B.1:2C.1:1D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于苯乙烯(![]() )的说法中不正确的是( )
)的说法中不正确的是( )
A. 分子中所有原子可能在同一个平面
B. 在一定条件下,1mol 苯乙烯最多消耗4mol H2
C. 和H2充分反应后的产物一氯代物有5种
D. 苯乙烯可发生还原反应、氧化反应、加成反应、加聚反应、取代反应等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式是( )
A. 氯气溶于水:Cl2 + H2O = 2H+ + Cl-+ ClO-
B. 用碳酸钠溶液吸收少量二氧化硫:![]() =
= ![]()
C. NaClO溶液与FeCl2溶液混合:Fe2+ + 2ClO- + 2H2O = Fe(OH)2↓ + 2HClO
D. NaHSO4溶液与Ba(OH)2溶液反应至中性: H++SO42—+Ba2++OH— = BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在酸性溶液中能大量共存且溶液呈无色透明的是
A.K+、Na+、SiO32-、Br-B.Na+、K+、CH3COO-、NO3-
C.K+、Cl-、Fe3+、SO42-D.Mg2+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的描述中,正确的是
A.乙醇在Cu催化下能被氧气氧化成乙醛
B.乙烯使高锰酸钾溶液和溴水褪色的原理相同
C.油脂可以水解生成氨基酸
D.葡萄糖能发生银镜反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲、乙、丙为组成生物体的相关化合物,乙为一个由α、β、γ三条多肽链形成的蛋白质分子,共含271个氨基酸,图中每条虚线表示由两个硫基(-SH)脱氢形成一个二硫键(-S-S-)。下列相关叙述不正确的是

A. 甲为组成乙的基本单位,且乙中最多含有20种甲
B. 由不同的甲形成乙后,相对分子质量比原来少了4 832
C. 丙主要存在于细胞核中,且在乙的生物合成中具有重要作用
D. 如果甲中的R为C3H5O2,则由两分子甲形成的化合物中含有16个H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POCl3广泛用于染料等工业。某化学学习小组借助拉瓦锡研究空气成分的曲颈甑(装置甲)合成PC13,并采取PCl3氧化法制备POCl3。
已知:(1)PCl3的熔点为-112℃,沸点为75.5℃,遇水生成H3PO3和HCl;
(2)2PCl3+O2==2POCl3。
【实验Ⅰ】制备PCl3
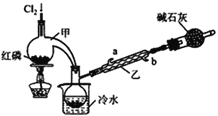
(1)实验室制备Cl2的原理是________________________。
(2)碱石灰的作用除了处理尾气外还有________________________。
(3)装置乙中冷凝水从_____(选填a或b)进入。
【实验Ⅱ】制备POCl3
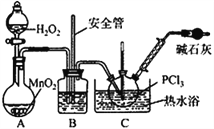
(4)实验室常用有微孔的试剂瓶保存H2O2,“微孔”与上述装置中的___________(仪器名称)目的是一致的。
(5)C中反应温度控制在60~65℃,其原因是________________________。
【实验Ⅲ】测定POCl3含量
①准确称取30.70gPOC13产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;
③加入10.00mL3.200mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④以Fe3+ 为指示剂,用0.2000mol/LKSCN 溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN 溶液。
已知:Ag++SCN-==AgSCN↓ Ksp(AgCl)>Ksp(AgSCN )。
(6)POC13水解的化学反应方程式为________________________。
(7)滴定终点的现象为____________,用硝基苯覆盖沉淀的目的是________________________。
(8)反应中POC13的百分含量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com