
【题目】下列叙述中不正确的是![]() 已知
已知![]() ,
,![]() ,
,![]()
A.![]() 溶液中有:
溶液中有:![]()
B.将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓![]() 溶液,AgCl沉淀质量大于AgBr沉淀
溶液,AgCl沉淀质量大于AgBr沉淀
C.向浓度均为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 溶液,
溶液,![]() 先形成沉淀
先形成沉淀
D.常温下,![]() 、浓度均为
、浓度均为![]() 的
的![]() 、
、![]() 混合溶液:
混合溶液:![]()
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】(题文)高聚物I和J在生产、生活中有广泛应用,其合成路线如图:

芳香烃R的分子式为C9H10,其苯环上只有一个取代基,R与H21:1加成后产物的核磁共振氢谱中有5组峰,峰面积之比为1:2:2:1:6。
已知:R'CH=CH2![]() R'CH2CH2Br
R'CH2CH2Br
回答下列问题:
(1)芳香烃R分子的官能团是_________(填官能团符号),R的最简单同系物是_____(填化学名称)。
(2)反应②的化学方程式为__________________。
(3)③和⑦的反应类型分别属于____________、______________________。
(4)高聚物J的结构简式为________________________。
(5)反应⑥的反应条件是______________________。
(6)H与T互为同分异构体,符合下列性质特征的H分子共有________种。
①能发生银镜反应②和氯化铁溶液反应显紫色③能使溴的四氧化碳溶液褪色
(7)仿照上述合成路线,设计一条以R为主要原料制备 的合成路线(无机试剂任选):____________________________________________________。
的合成路线(无机试剂任选):____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.lmol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是__________
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(2)取10mL乙溶液,加入等体积水,醋酸的电离平衡___________(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体 (假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___________(填“增大”“ 减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙) (填“>”、“ <”或“=”)。
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×l1-5 | 4.3×l0-7 | 3.0×10-8 |
K2 | - - | 5.6×10-11 | - - |
下列四种离子结合H+能力最强的是___________;
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=___________;取99mL甲溶液与lrnLlmol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“软电池”采用一张薄层纸片作为传导体,一面镀Zn,另一面镀MnO2。电池总反应为Zn+2MnO2+H2O=2MnO(OH)+ZnO。下列说法正确的是( )
A.该电池的正极为ZnO
B.Zn电极附近溶液的pH不变
C.电池正极的电极反应为2MnO2+2e-+2H2O=2MnO(OH)+2OH-
D.当0.1molZn完全溶解时,流经电解液的电子的物质的量为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系不正确的是( )
A.沸点:戊烷>2-甲基丁烷>2,2—二甲基丙烷>丙烷
B.密度:CCl4>CHCl3>H2O>苯
C.同分异构体数目:C5H12>C5H10>C4H10>C4H8>C3H8
D.等物质的量燃烧耗O2量:C5H12>C5H10>C4H10>C4H8>C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是

选项 | 操作 | 现象 | 结论 |
A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
B | ②中振荡后静置 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
C | ③加热 | 洗气瓶中溶液褪色 | 生成了乙烯 |
D | ④通电 | B极上有红色固体析出 | 锌的金属性比铜强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在密闭容器中进行下列反应:M(g) + N(g)![]() R(g) + 2L(?),此反应规律符合下图图像。
R(g) + 2L(?),此反应规律符合下图图像。
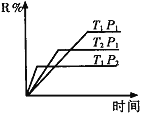
①T1______T2 ,正反应的△H______0。(填“>”、“<”或“=”,下同)。
②P1________P2, L为_______。(填“固”或“液”或“气”态)。
(2)合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)![]() H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
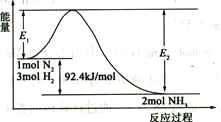
①在反应体系中加入催化剂,反应速率增大,E2的变化是_______(填“增大”、“减小”或“不变”)。②若在一密闭容器中加入1molN2和3molH2,在一定条件下充分反应,放出的热量____92.4kJ.(填“>”、“<”或“=”)。
③将1 mol N2和3 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,此时欲提高该容器中H2的转化率,下列措施可行的是_________(填字母)。
A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
C.改变反应的催化剂 | D.液化生成物分离出氨 |
④若在密闭容器中充入2molN2和6molH2反应达平衡时N2的转化率为40%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率分别为_____________mol、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为1.0mol/L的某澄清溶液中,还可能含有K+,Mg2+,Fe3+,Ba2+,Cl-,CO32-,SO32-,SiO32-,SO42-等离子,取该溶液100ml进行下图连续实验(所加试剂均过量,气体全部逸出)。下列说法不正确的是
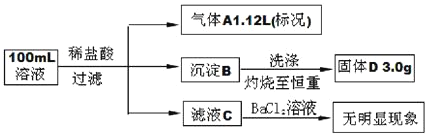
A.原溶液中一定不存在Mg2+,Fe3+,Ba2+,SO42-
B.在100ml原溶液中加入足量BaCl2溶液,至少可生成沉淀20.5g
C.为确定原溶液中是否含有Cl-,可取滤液C,加入AgNO3和稀HNO3溶液
D.原溶液一定存在K+,c(K+)可能为1.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com