
����Ŀ������أ�KIO3������Ҫ��ʳƷ���Ӽ���ij��ѧ��ȤС��������в�����ȡKIO3�������в�Ʒ�Ĵ��Ȳⶨ��
��ȡ���ᣨHIO3����ʵ��װ��ʾ��ͼ���й��������£�

HIO3 | �ٰ�ɫ���壬������ˮ�����������Ȼ�̼ ��Ka��0.169mol��L��1 |
KIO3 | �ٰ�ɫ���壬������ˮ���������Ҵ� �ڼ���������������Ӧ�� ClO��+ IO3- ��IO4 -+ Cl- |
�ش��������⣺
������� Cl2 ���� I2 ��ȡ HIO3
��1��װ�� A �з�����Ӧ�Ļ�ѧ����ʽ_______��
��2��װ�� B �е� CCl4 ���Լӿ췴Ӧ���ʣ�ԭ��_______��
��3����Ӧ������ȡ HIO3 ��Һ�IJ����У����貣���������ձ���________��_______��
������� KOH �к� HIO3 ��ȡ KIO3
��4�����кͷ�Ӧ�����ӷ���ʽΪ_______���к�֮ǰ��Ӧ������ HIO3��Һ������ӽ���ɫ�������к�ʱ������_______���ѧʽ�������� KIO3 �IJ�����
��5�����кͺ����Һ�м�������_______�������衢���á����˵Ȳ������õ���ɫ���塣
��6��Ϊ��֤���ȡ����������������ˮ���μ����� SO2 ������Һ��ҡ�ȣ��ټ��뼸�ε�����Һ����Һ��������ʵ��ʱ�����ӵ� SO2 ������Һ������������ɫ���֣�ԭ����_______��
����Ȳⶨ
��7��ȡ 0.1000 g ��Ʒ�ڵ���ƿ�У�����ϡ��������� KI ��Һ���� 0.1000 mol��L��1Na2S2O3��Һ�ζ����ӽ��յ�ʱ���������ָʾ���������ζ����յ㣬��ɫ��ʧ��I2+2S2O32-��2I-+S4O62-��������ƽ��ʵ���ƽ������ Na2S2O3 ��Һ�����Ϊ 24.00 mL�����Ʒ�� KIO3 ����������Ϊ_______��[M��KIO3����214.0 g��mol-1]
���𰸡�KClO3+6HCl(Ũ)=KCl+3Cl2��+3H2O I2��Cl2������CCl4�������˷�Ӧ��Ũ�� ��Һ©�� ������ HIO3+OH=IO3+H2O ClO �Ҵ�(�����ƾ�����C2H5OH��) ������SO2�ܽ�IO3-��I2�Ȼ�ԭΪI 85.60%
��������
��������Cl2����I2��ȡHIO3��Aװ���Ʊ�������Bװ��Cl2����I2��ȡHIO3��Cװ������β������������KOH�к�HIO3��ȡKIO3��1����ʵ��ԭ����װ��ͼ��֪��װ��A������غ�Ũ������ȡ������ͬʱ����KCl��ˮ���ݴ���д����2������Cl2��I2��ˮ���ܽ��С����CCl4���ܽ��ȴ�ܴ�������Ӧ��Ũ�ȣ��ݴ˿ɵã���3������������Ϣ��֪��B�з�Ӧ������ĵ�����Ҫ��ˮ��Һ������CCl4�������ܣ����Ա�����÷�Һ���Ի�ȡ������Һ��
��4��KOH��HIO3�����кͷ�Ӧ����KIO3��ˮ���ݴ���д���к�֮ǰ��Һ�д��ڽ϶�Cl2���к�ʱCl2ת��ΪClO-��������֪������������������Ӧ��ClO-+IO3-=IO4-+Cl-����������5������KIO3�������Ҵ���������6��SO2���л�ԭ�ԣ�������SO2��IO3-��I2�Ȼ�ԭΪI-����7��ȡ0.1000 g��Ʒ�ڵ���ƿ�У�����ϡ���������KI��Һ��������Ӧ��IO3-+5I-+6H+=3I2+3H2O����0.1000 molL-1Na2S2O3��Һ�ζ����ɵ�I2������KIO3��3I2��6S2O32-��ϵʽ���ɼ�������
��1��װ��A������ȡ��������ӦΪ��KClO3+6HCl(Ũ)=KCl+3Cl2��+3H2O���ʴ�Ϊ��KClO3+6HCl(Ũ)=KCl+3Cl2��+3H2O��
��2������Cl2��I2��ˮ���ܽ��С����CCl4���ܽ��ȴ�ܴ�װ��B�е�CCl4������Ӧ��Ũ�ȣ�ʹ��Ӧ���ʼӿ죬�ʴ�Ϊ��I2��Cl2������CCl4�������˷�Ӧ��Ũ�ȣ�
��3������������Ϣ��֪��B�з�Ӧ������ĵ�����Ҫ��ˮ��Һ������CCl4�������ܣ����Ա�����÷�Һ���Ի�ȡ������Һ����Һ��Ҫ�IJ����������ձ�����Һ©�������������ʴ�Ϊ����Һ©������������
��4��KOH��HIO3�����кͷ�Ӧ����KIO3��ˮ��HIO3����������ʣ������ӷ���ʽ�б�����ѧʽ�������ӷ���ʽΪ��HIO3+OH=IO3+H2O���к�֮ǰ��Һ�д��ڽ϶�Cl2��ͨ��������п��Գ�ȥCl2�������к�ʱCl2ת��ΪClO��ClO-��һ����IO3����ΪIO4���Ӷ�����KIO3�����½����ʴ�Ϊ��HIO3+OH=IO3+H2O��ClO��
��5��KIO3�������Ҵ������������Ҵ�����ʹKIO3����Һ�������������кͺ����Һ�м��������Ҵ��������衢���á����˵Ȳ������õ���ɫ���壻�ʴ�Ϊ���Ҵ�(�����ƾ�����C2H5OH��)��
��6���������֪����������SO2ˮ��Һ�ܽ�KIO3��ԭΪI2���������������SO2ˮ��Һȴ����ɫ���֣�˵��������SO2�ܽ�IO3-��I2�Ȼ�ԭΪI���ʴ�Ϊ��������SO2�ܽ�IO3-��I2�Ȼ�ԭΪI��
��7��ȡ0.1000g��Ʒ�ڵ���ƿ�У�����ϡ���������KI��Һ��������Ӧ��IO3+5I+6H+=3I2+3H2O����0.1000 mol/LNa2S2O3��Һ�ζ����ɵ�I2���й�ϵʽ��KIO33I26S2O32����n(KIO3)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ��0.1000mol/L��0.024L=0.0004mol��
��0.1000mol/L��0.024L=0.0004mol�� ![]() ��100%=85.60%���ʴ�Ϊ��85.60%��
��100%=85.60%���ʴ�Ϊ��85.60%��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����pH�Ķ��壬����ϡ��Һ���Զ���pC=-lgC��pKa=-lgKa�������£�ijŨ��H2A��Һ�ڲ�ͬpHֵ�£����pC(H2A)��pC(HA-)��pC(A2-)�仯��ͼ��ʾ������˵����ȷ����
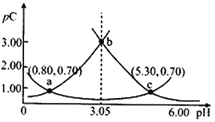
A. pH=3.50ʱ��c(H2A)>c(HA-)>c(A2-)
B. �����£�pKa1(H2A)=5.30��pKa2(H2A)=0.80
C. b��ʱ��![]() =104.50
=104.50
D. pH=3.00~5.30ʱ��c(H2A)+c(HA-)+c(A2-)��������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǵ�ⱥ�� NaCl ��Һ��ʵ��װ�ã�x��y ���Ƕ��Ե缫��a �DZ��� NaCl ��Һ��ͬʱ�����߸����뼸�η�̪��Һ�������йظ�ʵ����ȷ��˵����

A.x �缫Ϊ������y �缫Ϊ����
B.x �缫������Һ���ɫ�����д̼�����ζ�������
C.�������缫�����������ռ�������X�缫�õ���������Y�缫�õ�������֮��֮���Դ��� 1��1
D.������Һ���ȣ����ǰ����Һ�� pH δ�����仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼ��ʾ����CΪŨ���ᣬ������ָ�뷢��ƫת��B�缫����ΪFe ,A�缫����ΪCu����B�缫�ĵ缫��ӦʽΪ___________��A�缫�ĵ缫��ӦʽΪ_______����Ӧ����һ��ʱ�����ҺC��pH��___ (����ߡ������͡��������䡱)��

��2���ҹ��״�����������ˮ�����Ϊ��Դ�����͵ĺ�ˮ��־�ƣ��Ժ�ˮΪ�������Һ���������е�����ʹ����������������������ֻҪ�ѵƷ��뺣ˮ�����ӣ��ͻᷢ��ҫ�۵İ⡣���Դ�ĸ���������____��������ӦΪ___________��������ӦΪ_____________________________��
��3�����ε�ؾ��иߵķ���Ч�ʣ�����ܵ����ӣ�����Li2CO3��Na2CO3�������λ����������ʣ�COΪ����ȼ����������CO2�Ļ����Ϊ������ȼ�����Ƶ���650 ���¹�����ȼ�ϵ�أ�����йص�ط�Ӧʽ��������ӦʽΪ2CO��2CO32-��4e��=4CO2��������ӦʽΪ___________������ܷ�ӦʽΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ij�����ʽ��NaHY��ˮ��Һ�����������У���ȷ����
A. ����ʽ�ε�ˮ��Һһ��������
B. �ڸ�����Һ�У�����Ũ��Ϊ��c(Na+)��c(Y2-)��c(HY-)��c(OH-)��c(H+)
C. ��HY-��ˮ�⣬ˮ�ⷽ��ʽΪ��HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
D. ��HY-�ܵ��룬���뷽��ʽΪ��HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���������Ӧ���۾���ȷ���ǣ� ��
ѡ�� | |||
A | ��Fe(NO3)2��Һ�е��������ữ��H2O2��Һ | ��Һ��Ϊ��ɫ | �����ԣ�H2O2>Fe2+ |
B | ���������Һ�еμ����� | ��Һ����� | �ȵķǽ�����ǿ�ڹ裬�ʶ��������Ƶù��� |
C | ����ˮ�еμӱ������� | Һ����ֲַ㣬�ϲ�����ɫ���²㰴����ɫ | ��ͬ�¶��£����ڱ��е��ܽ��Զ��������ˮ�е��ܽ�ȡ� |
D | �������������ƹ���Ͷ����ɫʯ����Һ�� | ��Һ�����ɫ | ����������ˮ��Ӧ�����������ƣ���Һ�ʼ��� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�����û�ѧƽ���ƶ�ԭ�����͵��ǣ� ��
A.���ű���ʳ��ˮ���ռ�����
B.��ѹ����������N2��H2��Ӧ����NH3
C.��ʢ��NO2�����������ˮ����ɫ����
D.�Ӵ�����ʹN2��H2��һ����������ת��ΪNH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��10��9��ŵ������ѧ�������λ��ѧ�ң��Ա�������������ӵ������Ĺ��ס���þ����﮿����ӵ�ص������ܶȣ�һ��þ��ص��ܷ�Ӧ���£�![]() ���øõ����̼���϶�ͭװ����ͼ������˵����ȷ����
���øõ����̼���϶�ͭװ����ͼ������˵����ȷ����![]()
![]()
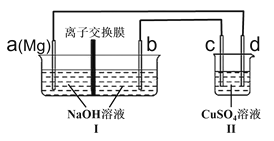
A.װ�â�ŵ�ʱ��b�缫��ӦʽΪ��![]()
B.װ��II��d����̼������ͨ��·������ͭ��ҺŨ�ȼ�С
C.װ��I�����ʺ��������ӽ���Ĥ��![]() ��b���ƶ�
��b���ƶ�
D.���������ӽ���Ĥ����![]() ͨ��ʱ������þ12g
ͨ��ʱ������þ12g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���о��к���ɫ����������Աȷ������ý��۲���ȷ���ǣ� ��
|
|
|
�� | �� | �� |
A.�ɢ��еĺ���ɫ���壬�ƶϲ���������һ���ǻ������
B.����ɫ���岻�ܱ�������ľ̿��Ũ���ᷢ���˷�Ӧ
C.�ɢ�˵��Ũ������лӷ��ԣ����ɵĺ���ɫ����Ϊ��ԭ����
D.�۵���������м���CO2���ɴ�˵��ľ̿һ����Ũ���ᷢ���˷�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com