
| ||
| m |
| M |
| n |
| V |
| 6.4g |
| 64g/mol |
| ||
| 0.1mol×2 |
| 1 |
| 0.72mol |
| 0.5L |
| 0.1mol×1 |
| 1 |


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
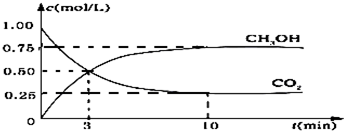
| n(CH3OH) |
| n(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1=Q2=92.4 |
| B、Q1=Q2<92.4 |
| C、Q1<Q2<92.4 |
| D、Q2<Q1<92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
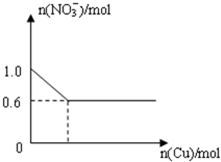 将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
| A | 碱 | 酸 | 石芯 | (乙) |
| B | 酸 | 碱 | 酚酞 | (甲) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去混在氯化钠固体中的氯化铵或单质碘,均可用升华的方法 |
| B、若FeCl2溶液中含有I-杂质,可用过量的Cl2氧化后进行萃取分液 |
| C、CO2中含有HCl杂质:通入饱和NaHCO3溶液,洗气 |
| D、鉴别固体Na2CO3和NaHCO3,可以分别配成溶液,再加入澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为了使食品较长时间保持色香味和口感,可加放适量的苯甲酸钠 |
| B、为了增加婴幼儿奶粉中的含氮量,可在奶粉中适当添加尿素或三聚氰胺 |
| C、在肉制品加工中加大量的亚硝酸钠以保持肉类新鲜 |
| D、在缺碘地区,人们需要用添加碘单质的食盐来补充碘元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化氢与氨气相遇,有大量的白雾生成 |
| B、SO2通入品红溶液,红色褪去,再加热,红色不再出现 |
| C、SO2具有氧化性,可用于漂白纸浆 |
| D、用铂丝蘸取硫酸钠溶液灼烧,火焰呈黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com