
【题目】在10mL pH=4的盐酸中加水,稀释到100mL时,溶液pH为______;若加水稀释到1000mL时,溶液pH为________;若加水稀释到10000L时,溶液pH________
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种重要的化工产品。它不溶于H2SO4、HNO3 和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],n随着环境酸度的改变而改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如图:
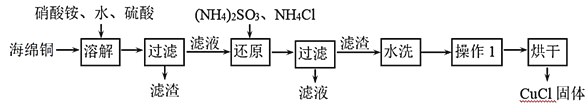
(1)还原过程中主要反应的离子方程式为_______。
(2)实验室为了加快过滤速度,往往采用抽滤的操作(如图)。仪器A的名称__________,有关抽滤,下列说法正确的是__________
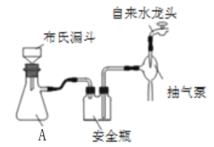
A.抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,最后将滤液从吸滤瓶上口倒出
B.在布氏漏斗中放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C.在抽滤装置中洗涤晶体时,为减少晶体溶解损失,应使洗涤剂快速通过滤纸
D.减压过滤不宜用于过滤胶状或颗粒太小的沉淀
(3)操作1为马上再洗涤,然后在真空干燥机内于70℃干燥2h,冷却、密封包装。其中最合理的洗涤试剂__________
A. 浓盐酸 B. 浓氨水 C. 无水乙醇 D. 水+乙醇
真空干燥的原因是___________。
(4)随着pH减小,Cu2(OH)4-nCln中铜的质量分数__________
A. 增大 B. 不变 C. 减小 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置能达到实验目的的是
A.  分离CH3COOH和CH3COOC2H5混合液
分离CH3COOH和CH3COOC2H5混合液
B.  验证NH4NO3晶体溶于水的热效应
验证NH4NO3晶体溶于水的热效应
C.  蒸发FeCl3溶液得到FeCl3固体
蒸发FeCl3溶液得到FeCl3固体
D. 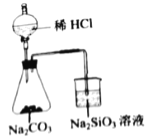 验证C、Cl、Si的非金属性强弱
验证C、Cl、Si的非金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下醋酸分子不可能存在于pH>7的碱性溶液中
B. 常温下pH=2的H2SO4与pH=13的NaOH溶液混和,所得混和液的pH=11,则H2SO4溶液与NaOH溶液的体积比是9:1
C. 0.1mol/L硫化钠溶液中,c(S2-)+c(HS-)+2c(H2S)=0.1mol/L
D. 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津危险品仓库起火引发爆炸,产生的CN-污染可用右图所示装置除去含CN-废水中的CN-,控制溶液pH为9~10并加入食盐,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
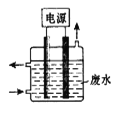
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.已知X在一定条件下转化为Y,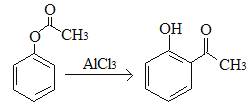 ,X与Y互为同分异构体,可用FeCl3溶液鉴别
,X与Y互为同分异构体,可用FeCl3溶液鉴别
B.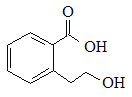 能发生的反应类型有:加成反应、取代反应、消去反应、水解反应
能发生的反应类型有:加成反应、取代反应、消去反应、水解反应
C.淀粉、蛋白质最终的水解产物都只有一种
D.香柠檬粉具有抗氧化功能,结构为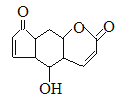 ,它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH
,它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液100mL,其中可能含Fe3+、Al3+、Na+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示。

请回答下列问题:
(1)焰色反应是_____(填“物理”或“化学”)变化;实验③中产生的无色无味气体是_____(填化学式)。
(2)原溶液中一定存在的离子有_____,一定不存在的离子有_____(写化学式)。
(3)若溶液中K+物质的量为0.04mol,则c(Na+)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔加氢是乙烯工业中的重要精制反应,利用这一反应可以将乙烯产品中的乙炔含量降低,以避免后续乙烯聚合催化剂的中毒,工业上称为碳二加氢过程。
已知:I. ![]()
![]() ;
;
II. ![]()
![]() ;
;
回答下列问题:
(1)已知几种化学键的键能如表所示:
化学键 |
|
|
|
|
键能/ | 436 | 413.4 | 615 | 812 |
![]() =____________
=____________![]() 。
。
(2)400K时,在密闭容器中将等物质的量的![]() 和
和![]() 混合,采用适当的催化剂进行反应,生成
混合,采用适当的催化剂进行反应,生成![]() ,达到平衡时测得
,达到平衡时测得![]() ,则平衡时
,则平衡时![]() _____
_____![]() 。
。
(3)据前人研究发现乙炔在![]() 团簇表面催化加氢反应的部分历程如图所示,其中吸附在
团簇表面催化加氢反应的部分历程如图所示,其中吸附在![]() 表面上的物种用*标注。
表面上的物种用*标注。

推测乙烯在![]() 表面上的吸附为__________(填“放热”或“吸热”)过程。图中历程中最大能垒(活化能)E正=______
表面上的吸附为__________(填“放热”或“吸热”)过程。图中历程中最大能垒(活化能)E正=______![]() ,该步骤的化学方程式为___________。
,该步骤的化学方程式为___________。
(4)![]() 时,将体积比为1:2的
时,将体积比为1:2的![]() 和
和![]() 充入刚性密闭容器中,加入催化剂发生反应Ⅱ,起始体系总压强为
充入刚性密闭容器中,加入催化剂发生反应Ⅱ,起始体系总压强为![]() ,实验测得
,实验测得![]() 的分压
的分压![]() 与反应时间
与反应时间![]() 的关系如图所示:
的关系如图所示:
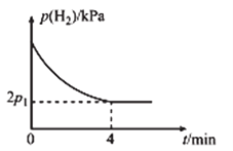
①![]() 时,
时,![]() 内,平均反应速率
内,平均反应速率![]() ______
______![]() (用含
(用含![]() 的代数式表示,下同)。
的代数式表示,下同)。
②![]() 时,该反应的化学平衡常数
时,该反应的化学平衡常数![]() _____
_____![]() (
(![]() 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
③![]() 时,
时,![]() 内,
内,![]() 的减小量______(填“>”“<”或“=”)
的减小量______(填“>”“<”或“=”) ![]() 内
内![]() 的减小量,理由为__________。
的减小量,理由为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com