
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如表
2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如表
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法不正确的是
A.反应前2min的平均速率v(Z)=2.0×10-3mol/(L·min)
B.其他条件不变,升高温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数不变
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
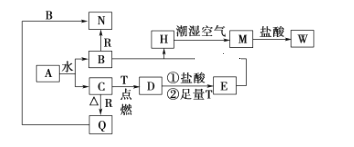
(1)写出下列物质的化学式A:_______________,Q:_____________,W:__________________。
(2)按要求写出下列反应方程式:
①H在潮湿空气中变成M的过程中的化学方程式:_______________________
②R与B溶液反应时的离子方程式:___________________________________
③D与盐酸反应的离子方程式:_______________________________________
(3)简述检验气体C的方法:___________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.天然气、水煤气、液化石油气均是生活中常用的燃料,它们的主要成分都是化合物
B.无水![]() 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
C.制玻璃和水泥都要用到石灰石原料
D.1996年人工合成了第112号元素鎶(Cn),盛放鎶的容器上应该贴的标签是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图所示:
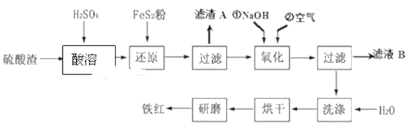
回答下列问题:
(1)酸溶时,粉碎硫酸渣的目的是__________
(2)还原过程中加入FeS2粉增大溶液中Fe2+的含量,同时有H2SO4生成,完成该反应的离子方程式:FeS2+14Fe3++______H2O═15Fe2++______SO42-+______.______________
(3)滤渣A的主要成分为__________
(4)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_____;(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
为得到纯净的Fe(OH)3固体,需要对沉淀进行洗涤,判断沉淀Fe(OH)3是否洗净的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用废干电池中黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)制备MnSO4晶体的工艺流程如图:
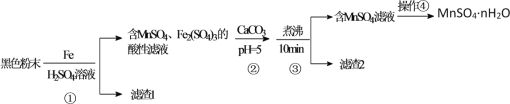
下列说法错误的是( )
A.反应①中1molFe至多还原1.5molMnO2
B.重金属主要在滤渣2中
C.步骤③煮沸可使沉淀颗粒长大,目的是便于固液分离
D.合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A.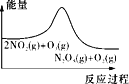 平衡后升温,NO2含量降低
平衡后升温,NO2含量降低
B.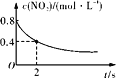 0~2 s内,v(O3)=0.2 mol·L-1·s-1
0~2 s内,v(O3)=0.2 mol·L-1·s-1
C.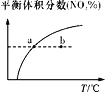 v正:b点>a点,b点:v逆 > v正
v正:b点>a点,b点:v逆 > v正
D.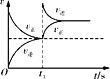 恒温,t1时再充入O3
恒温,t1时再充入O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子。

该物质的结构简式为__,该物质中所含官能团的名称为__。
(2)下列各组物质:①O2和O3②H2、D2、T2③12C和14C④CH3CH2CH2CH3和(CH3)2CH2CH3⑤乙烷和丁烷⑥CH3CH2CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)C2H5互为同系物的是__,互为同分异构体的是__,互为同位素的是__,互为同素异形体的是__,是同一物质的是__。
(3)酚酞是常用的酸碱指示剂,其结构简式如图所示:

①酚酞的分子式为__。
②从结构上分析酚酞可看作__。
A.烯烃 B.芳香化合物 C.醇类物质 D.酚类物质 E.醚类物质 F.酯类物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1905年哈珀开发实现了以氮气和氢气为原料合成氨气,生产的氨制造氮肥服务于农业,养活了地球三分之一的人口,哈珀也因此获得了1918年的诺贝尔化学奖。
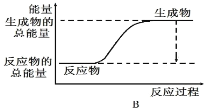
(1)工业合成氨的反应如下:N2+3H2 2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成2 mol NH3 的能量变化为__________kJ。 下图能正确表示该反应中能量变化的是__________(填“A”或“B”)。
2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成2 mol NH3 的能量变化为__________kJ。 下图能正确表示该反应中能量变化的是__________(填“A”或“B”)。

(2)反应2NH3(g)![]() N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为 0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为 0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
① | 400℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
② | 400℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
③ | 500℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据回答:实验①②中,有一个实验使用了催化剂,它是实验_____(填序号);实验①③对比说明了_________________________________。在恒温恒容条件下,判断该反应达到化学平衡状态的标志是_________(填序号)。
a. NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
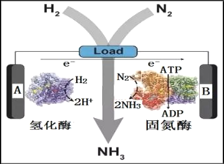
(3)近日美国犹他大学 Minteer教授成功构筑了H2—N2生物燃料电池。该电池类似燃料电池原理,以氮气和氢气为原料、氢化酶和固氮酶为两极催化剂、质子交换膜(能够传递H+)为隔膜,在室温条件下即实现了氨的合成同时还能提供电能。则A电极为_____极(填“正”、“负”),该电池放电时溶液中的H+向______极移动(填“A”、“B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2LH2O中含有的质子数目为5NA
B.80mL10mol·L-1盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA
C.标况下11.2LNO和11.2LO2混合后所得气体分子数为NA
D.KClO3+6HCl=KCl+3Cl2↑+3H2O生成3molCl2转移5mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com