
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图所示:
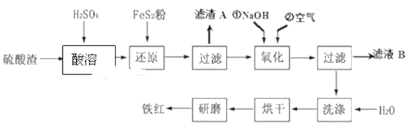
回答下列问题:
(1)酸溶时,粉碎硫酸渣的目的是__________
(2)还原过程中加入FeS2粉增大溶液中Fe2+的含量,同时有H2SO4生成,完成该反应的离子方程式:FeS2+14Fe3++______H2O═15Fe2++______SO42-+______.______________
(3)滤渣A的主要成分为__________
(4)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_____;(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
为得到纯净的Fe(OH)3固体,需要对沉淀进行洗涤,判断沉淀Fe(OH)3是否洗净的方法是__________。
【答案】增大接触面积,加快溶解速率 FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+ SiO2 3.2~3.8 取少量最后一次洗涤液于洁净的试管中,滴加少量BaCl2溶液,若无明显现象,则沉淀已洗净
【解析】
Fe2O3、MgO为碱性氧化物,SiO2为酸性氧化物,Al2O3为两性氧化物,Fe2O3、MgO、Al2O3与硫酸反应,生成可溶的Fe2(SO4)3、Al2(SO4)3、MgSO4,根据问题(2),加入FeS2,将Fe3+还原成Fe2+,过滤后,向滤液中通入空气,将Fe2+氧化成Fe3+,加入NaOH,调节pH,使Fe3+以Fe(OH)3形式沉淀出来,然后经过过滤、烘干、研磨得到铁红;
(1)粉碎硫酸渣的目的是增大硫酸渣与硫酸的接触面积,加快溶解速率,提高原料的浸出率;
(2)FeS2中S的化合价由-1价→+6价,化合价升高7价,FeS2整体升高14价,Fe3+作氧化剂,化合价降低1价,最小公倍数为14,Fe3+系数为14,FeS2系数为1,SO42-系数为2,根据原子守恒、电荷守恒,离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
(3) Fe2O3、MgO为碱性氧化物,SiO2为酸性氧化物,Al2O3为两性氧化物,Fe2O3、MgO、Al2O3与硫酸反应,生成可溶的Fe2(SO4)3、Al2(SO4)3、MgSO4,SiO2不与稀硫酸反应,即滤渣1为SiO2;
(4)根据上述分析,让Fe3+以Fe(OH)3形式沉淀出来,而Mg2+、Al3+不能沉淀,即pH控制在3.2~3.8之间;Fe(OH)3表面沾有Na2SO4,需要检验SO42-,具体操作是:取少量最后一次洗涤液于洁净的试管中,滴加少量BaCl2溶液,若无明显现象,则沉淀已洗净。


科目:高中化学 来源: 题型:
【题目】有机物的结构式可用“键线式”简化表示。如CH3一CH=CH一CH3可简写为![]() 。有机物X的键线式为:
。有机物X的键线式为: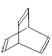 。下列说法不正确的是
。下列说法不正确的是
A.X与苯中碳元素的质量分数相同
B.有机物Y是X的同分异构体,且属于芳香烃,能使溴水褪色,则Y为苯乙烯
C.X能使酸性高锰酸钾溶液褪色
D.X 与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。
(1)In在周期表中的位置是___。
(2)In的最高价氧化物的水化物的碱性___Ba(OH)2的碱性(填“>”或“<”)。
(3)![]() In的中子数与电子数的差值为___。
In的中子数与电子数的差值为___。
II.A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
C.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(4)C-的电子式:___。
(5)A+、B2-、F3+离子半径由大到小的顺序为___(用离子符号表示)。
(6)电子式表示A2B的形成过程___。
(7)含F3+的溶液中通入过量D,反应的离子方程式是___。
(8)A单质与E反应的离子方程式为___,生成的化合物中化学键的类型是___。
III.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(9)Se原子结构示意图可表示为___。
(10)下列说法合理的是___。
a.SeO2既有氧化性又有还原性
b.浓硒酸可能具有强氧化性、脱水性
c.热稳定性:H2Se<HCl<H2S
d.酸性:H2SeO4<HBrO4<HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁原子的价电子排布式为_______。铁、钴、镍的基态原子核外未成对电子数最多的是________。
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的[Co(NH3)6]Cl3晶体。该配合物中配体分子的立体构型是_______,其中心原子的杂化轨道类型为_________。
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253K, 沸点为376K,则Ni(CO)4固体属于_____晶体,其中存在的化学键类型为_________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO_______FeO (填 “>”“<” 或“=”),原因是___________。
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为______,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_____pm。(写出计算表达式)
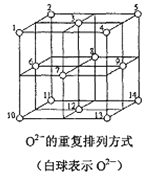
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )
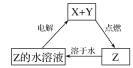
A. X可能是金属铜 B. Y不可能是氢气
C. Z可能是氯化钠 D. Z可能是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:![]() 元素原子价电子排布式为
元素原子价电子排布式为![]() ,且原子半径是同族元素中最小的。
,且原子半径是同族元素中最小的。![]() 元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。
元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。![]() 元素的电离能数据如表
元素的电离能数据如表![]() :
:
|
|
|
|
|
496 | 4562 | 6912 | 9540 |
|
请回答:
![]() 的电子式为______,含有的化学键类型为______,
的电子式为______,含有的化学键类型为______,![]() 为______晶体。
为______晶体。
![]() 遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
![]() 、Y、Z、W四种元素所形成的单质中,硬度最大的是______
、Y、Z、W四种元素所形成的单质中,硬度最大的是______![]() 填物质的名称
填物质的名称![]() ;晶体
;晶体![]() 明显高的原因是______;
明显高的原因是______;![]() 中X原子的杂化轨道类型为______。
中X原子的杂化轨道类型为______。
![]() 晶体的结构示意图如图所示。设该晶体的摩尔质量为
晶体的结构示意图如图所示。设该晶体的摩尔质量为![]() ,晶体的密度为
,晶体的密度为![]() 阿伏加德罗常数为
阿伏加德罗常数为![]() ,则晶体中两个最近的Z离子中心间的距离
,则晶体中两个最近的Z离子中心间的距离![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如表
2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如表
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法不正确的是
A.反应前2min的平均速率v(Z)=2.0×10-3mol/(L·min)
B.其他条件不变,升高温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如图所示:可能用到的有关数据如下:

相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成:在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(1)碎瓷片的作用是___;a的名称是__;
(2)a中发生主要反应的化学方程式为___;本实验最容易产生的有机副产物的结构简式为___。
Ⅱ.分离提纯:将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为6.15g。
(3)用碳酸钠溶液洗涤的作用是___,操作X的名称为___。
Ⅲ.产物分析及产率计算:
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有__种不同化学环境的氢原子。②本实验所得环己烯的产率是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
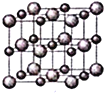
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。预计在未来20年里,不可能有替代钕铁硼磁铁的磁性材料岀现。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其他稀土原料。
(1)钕(Nd)为60号元素,在周期表中第_________周期;基态铁原子的外围电子轨道表示式为__________________。
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。
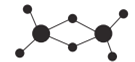
①已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于_________分子(填“极性”或“非极性”),分子中A1原采取__________________杂化。
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[A1(OH)4]-中存在的化学键有_________(填选项字母)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
(3)B元素及与其同周期相邻的两种元素第一电离能由小到大的顺序为__________________(用元素符号表示)。
(4)因材料中含有大量的钕和铁,容易锈蚀是它的一大弱点。可电镀镍(Ni)、锌(Zn)等进行表面涂层处理。已知Ni可以形成[Ni(NH3)6]Cl2,该配合物中配体分子的空间构型为__________________。
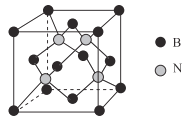
(5)已知立方BN晶体硬而脆,其原因是___________________________;其晶胞结构如图所示,N原子填充在B原子构成的正四面体空隙中,则晶胞中正四面体的空隙填充率为__________________,设晶胞中最近的B、N原子之间的距离为anm,晶体的密度为bg·cm-3,则阿伏加德罗常数为_________mol-1(列式即可,用含a、b的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com