
【题目】氢氧化钠固体在实验室保存中容易变质。现取一定量的久存氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系

(不考虑CO2在水中的溶解)。试计算:
(1)盐酸的物质的量浓度为________mol/L。
(2)该样品中NaOH与Na2CO3物质的量之比为________。
(3)若该氢氧化钠固体样品溶于水后用于吸收CO2,最多能吸收CO2的体积(标况下)是________
【答案】0.4 2:1 1.344L
【解析】
(1)产生CO2反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑, 根据产生CO2的体积计算其物质的量,再由反应的化学方程式计算消耗HCl的物质的量,从而计算所用稀盐酸的物质的量浓度;
(2)根据消耗盐酸的量,确定溶液中NaCl的量,进而根据钠守恒,确定原固体中所含NaOH的量;
(3)吸收CO2的过程中,NaOH和Na2CO3都转化为NaHCO3 , 根据反应的化学方程式计算吸收CO2的量。
(1)产生CO2的物质的量![]() ;
;
由反应的化学方程式:NaHCO3+HCl=NaCl+H2O+CO2↑可得,反应消耗的HCl的物质的量为0.02mol,且参与反应的稀盐酸的体积为50mL,故所用稀盐酸的物质的量浓度![]() ;
;
(2)当加入200mL稀盐酸时,溶液中所含溶质为NaCl,其物质的量n(NaCl)=n(HCl)=0.4mol/L×0.2L=0.08mol;
由碳守恒,可得原固体中n(Na2CO3)=n(CO2)=0.02mol;
由钠守恒,可得原固体中n(NaOH)=n(NaCl)-2n(Na2CO3)=0.08mol-2×0.02mol=0.04mol;
故该样品中NaOH与Na2CO3的物质的量之比为:0.04mol:0.02mol=2:1;
(3)NaOH吸收足量的CO2后最终转化为NaHCO3 ,该反应的化学方程式为:CO2+NaOH=NaHCO3 ,故可吸收CO2的物质的量n(CO2)=n(NaOH)=0.04mol;
Na2CO3吸收CO2 后转化为NaHCO3 ,该反应的化学方程式为:Na2CO3+CO2+H2O=2NaHCO3 ,故可吸收CO2的物质的量n(CO2)=n(Na2CO3)=0.02mol;
故可吸收CO2的体积(标况下)V=n×Vm=(0.04mol+0.02mol)×22.4L/mol=1.344L。


科目:高中化学 来源: 题型:
【题目】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的过程如下:
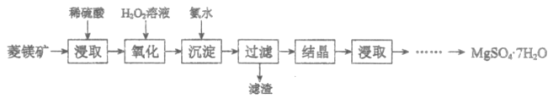
(1)MgCO3溶于稀硫酸的离子方程式是___________。
(2)“氧化”步骤中,加入H2O2溶液的目的是___________(用离子方程式表示)。
(3)“沉淀”步骤中,用氨水调节溶液pH的范围是___________。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
(4)“过滤”所得滤液中含有的阳离子是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A.化学键的断裂和生成是化学反应中能量变化的根本原因
B.凡吸热反应均需在加热条件下才能发生
C.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
D.因为石墨变成金刚石吸热,所以石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数数的值,下列说法不正确的是( )
A.标准状况下,1.8gH2O中所含分子数为0.1NA
B.常温常压下,14gCO和N2混合气所含质子总数为7NA
C.含0.2molH2SO4的浓硫酸与足量Mg反应,转移电子数为0.2NA
D.足量Fe在0.1molCl2中充分燃烧,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是( )

A.a点时溶液中阳离子仅为Cu2+和Fe2+
B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C.c点时加入的铁粉与Cu2+反应
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向20.00 mL 0.10 mol/L Na2CO3溶液中逐滴加入0.10 mol/L盐酸40.00 mL,所得溶液的pH与加入盐酸体积的关系如表所示:
溶液的pH | 加入盐酸的总体积 |
12 | V(HCl)=0 |
8 | V(HCl)=20.00 mL |
5 | V(HCl)=40.00 mL |
回答下列问题:
(1)20.00 mL 0.10 mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?______ (用等式表示)。
(2)当V(HCl)=20.00 mL时,溶液呈碱性的原因是________(用离子方程式和必要的文字说明)此时溶液中c(H2CO3)____(填“>”、“<”或“=”)c(CO32—)。
(3)V(HCl)=40.00 mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3—+H+的电离常数K1=_____。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____(填“变大”、“变小”或“不变”)。
HCO3—+H+的电离常数K1=_____。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____(填“变大”、“变小”或“不变”)。
(4)若向20 mL 0.10 mol/L Na2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(Ba2CO3)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的叙述中不正确的是( )
A.合金具有熔点高硬度大等特性B.目前用量最大、用途最广泛的合金是钢
C.在我国使用最早的合金是青铜D.合金钢可制成不锈钢和特种钢等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、SO42-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是( )

A. 该溶液X中Na+、Cl-一定有
B. 溶液Y中加入氯化钡溶液没有沉淀
C. 该溶液可能是硫酸亚铁、碘化钾和氯化钠溶于水后得到的
D. 原溶液X中滴加几滴KSCN溶液后,再滴加少量的次氯酸钠溶液后溶液呈血红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 硅晶体和二氧化硅晶体中都含共价键
B. 冰和干冰熔化时克服的作用力均为分子间作用力
C. 硫晶体和硫酸钠晶体均属于离子晶体
D. 氯气和四氯化碳分子中每个原子的最外电子层都形成了具有8个电子的稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com