
【题目】(1)250C、101kPa时,____________纯物质完全燃烧生成__________时所放出的热量,叫做该物质的燃烧热。
(2)已知:①P4(s,白磷)+5O2(g)=P4O10(s)△H=—2983.2kJmol-1
②P(s,红磷)+5/4O2(g)=1/4P4O10(s)△H=—738.5kJmol-1
写出白磷转化为红磷的热化学方程式: __。
(3)已知:①Fe2O3(s)+3CO(g)==2Fe(s)+3CO2(g)△H1=-26.7kJ/mol
②3Fe2O3(s)+CO(g)==2Fe3O4(s)+CO2(g)△H2=-50.75kJ/mol
③Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H3=-36.5kJ/mol
计算反应:2FeO(s)+2CO(g)==2Fe(s)+2CO2(g)的△H =_ __
【答案】(1)1mol,稳定氧化物。
(2)P4(s)=4P(s)△H=-29.2kJ/mol。
(3)△H =+14.55KJ/mol
【解析】
试题分析:(1)根据定义,250C、101kPa时,1mol纯物质完全燃烧生成稳定氧化物时所放出的热量,叫做该物质的燃烧热;
(2)已知:①P4(s,白磷)+5O2(g)=P4O10(s)△H=—2983.2kJmol-1
②P(s,红磷)+5/4O2(g)=1/4P4O10(s)△H=—738.5kJmol-1
根据盖斯定律,①-②×4得白磷转化为红磷的热化学方程式:
P4(s)=4P(s)△H=-29.2kJ/mol;
(3)已知:①Fe2O3(s)+3CO(g)==2Fe(s)+3CO2(g)△H1=-26.7kJ/mol
②3Fe2O3(s)+CO(g)==2Fe3O4(s)+CO2(g)△H2=-50.75kJ/mol
③Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H3=-36.5kJ/mol
根据盖斯定律,①-③×![]() -②×
-②×![]() 得
得
2FeO(s)+2CO(g)=2Fe(s)+2CO2(g)的△H=+14.55KJ/mol。


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】为研究(NH4)2SO4和NH4HSO4混合物样品组成,称取四份该样品分别逐滴加入相同浓度的NaOH溶液25.0 mL,加热并完全反应,产生NH3的体积(NH3的体积已折算成标准状况,不考虑NH3在水中的溶解)如下表:
实验序号 | I | II | III | IV |
NaOH体积(mL) | 25.0 | 25.0 | 25.0 | 25.0 |
样品质量(g) | 3.62 | 5.43 | 7.24 | 10.86 |
NH3体积(mL) | 896 | 1344 | 1344 | 896 |
(1)样品中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(2)NaOH溶液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一真空容器中,充入10 mol N2,30 mol H2,发生反应N2(g)+3H2(g)![]() 2NH3(g),在一定条件下达到平衡时,N2的转化率为25%。若在同一容器中,在相同温度下,向容器中充入NH3,欲使达到平衡时各成分的质量分数与上述平衡相同,则起始时NH3的量和达到平衡时NH3的转化率为
2NH3(g),在一定条件下达到平衡时,N2的转化率为25%。若在同一容器中,在相同温度下,向容器中充入NH3,欲使达到平衡时各成分的质量分数与上述平衡相同,则起始时NH3的量和达到平衡时NH3的转化率为
A. 20 mol、25% B. 20 mol、75% C. 40 mol、30% D. 10mol、50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,反应2SO2(g)+O2(g)![]() 2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积
2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积![]() (SO3)随温度变化的曲线应为 ( )
(SO3)随温度变化的曲线应为 ( )
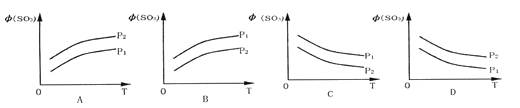
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,可大量共存的离子是( )
A.K+ Na+ OH﹣ SO42﹣
B.Mg2+ SO42﹣ NH4+ Cl﹣
C.K+ Na+ HCO3﹣ Cl﹣
D.K+ Na+ NO3﹣ CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,AgCl在水溶液中的沉淀溶解平衡曲线如图所示。在该温度下,下列说法中不正确的是( )
A.a点和b点对应的Ksp(AgCl)相等
B.Ksp(AgCl)=2×10-10
C.可采取蒸发溶剂的方法使溶液从c点变到b点
D.已知Ksp(AgI)=8.5×10-17,向含KI和KCl的溶液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() =4.25×10-7
=4.25×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系2v(B)=3v(A),3v(C)=2v(B)。则此反应可表示为
A.2A+3B=2C B.A+3B=C C.3A+B=2C D.A+B=C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜的制备实验是化学实验教学中一个必做实验,某学习小组设计了如下两个实验方案:
实验一:
因铜不能与稀硫酸反应,实验中用铜和浓硫酸加热使之完全反应,将溶液通过蒸发、结晶等操作得到硫酸铜晶体。
(1)根据上述实验和反应,比较浓硫酸与稀硫酸的性质,浓硫酸具有 。
(2)该反应的化学方程式为 。
实验二:
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,其反应原理为2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ,但反应速率太慢,当升高温度到80~90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
(3)Fe2(SO4)3的作用是 。
(4)得到的混合液可以用下列四种物质中的 调节溶液的pH =2~4,使Fe3+ 形成Fe(OH)3沉淀而除去:
A.NaOH B. CuO C. CuCO3 D.Fe
(5)请根据以上内容,对这两个实验方案进行评价,填下表:
实 验 (一) | 实 验 (二) | |
主要优点 | 操作简便 | (1)原料充分转化为产品 (2)没有有害气体排放 |
主要缺点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时:
①HF(aq)+OH-(aq)=F-(aq)+H2O(l)ΔH1=-67.7kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l)ΔH2=-57.3kJ·mol-1
③Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH3<0
下列说法正确的是( )
A. HF的电离方程式及热效应:HF(aq)![]() H+(aq)+F-(aq) ΔH>0
H+(aq)+F-(aq) ΔH>0
B. 在氢氧化钠溶液与盐酸的反应中,氢氧化钠溶液量越多,中和热越大
C. ΔH2=-57.3 kJ·mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热
D. 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-114.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com