
| 催化剂 |
| 催化剂 |
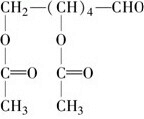 ,故答案为:
,故答案为: .
.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| A、这两个反应都是氧化还原反应 |
| B、反应①中MgAt2既是氧化产物,又是还原产物 |
| C、反应②中AtI既是氧化剂,又是还原剂 |
| D、MgAt2的还原性弱于MgI2的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
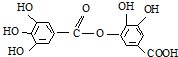 关于它的性质叙述中,正确的是( )
关于它的性质叙述中,正确的是( )| A、它有弱酸性,能与KOH反应 |
| B、可以水解生成一种生成物 |
| C、不能与强碱溶液反应 |
| D、可以水解生成两种生成物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下气体的摩尔体积为22.4L |
| B、NH3的摩尔质量为17g/mol |
| C、18gH2O中约含有0.5mol水分子 |
| D、1L0.1mol/L的H2SO4溶液中含有0.1molSO42-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 对于N2O4(g)?2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示.
对于N2O4(g)?2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
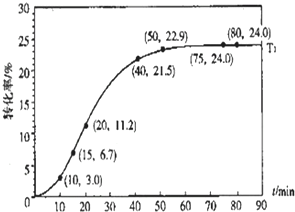 某种甲酸酯水解反应方程式为:
某种甲酸酯水解反应方程式为:| 组分 | HCOOR | H2O | HCOOH | ROH |
| 物质的量浓度/mol?L一1’ | 1.00 | 1.99 | 0.01 | 0.52 |
| 反应时间/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均速率/10-3mol?L-1?min-1 | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com