���㣺Ԫ�������ɺ�Ԫ�����ڱ����ۺ�Ӧ��
ר�⣺Ԫ����������Ԫ�����ڱ�ר��
��������Ԫ�������ڱ���λ�ã���֪��ΪH����ΪN����ΪO����ΪNa����ΪAl����ΪS����ΪClԪ�أ�
��1����ΪOԪ�أ���ԭ�Ӻ�����2�����Ӳ㡢������������6��ԭ�ӵ��Ӳ���������������ȡ�����Ԫ������������������������ȣ���ΪSԪ�أ���ԭ�Ӻ�����3�����Ӳ㡢������������6��
��2��ͬһ����Ԫ�أ�ԭ�Ӱ뾶����ԭ�������������С��Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ��
��3��Ԫ�آڵ���̬�⻯��Ϊ����������������Nԭ�Ӻ�ÿ��Hԭ�ӹ���һ�Ե��ӣ���Nԭ�ӻ���һ���µ��Ӷԣ�һ����˵����ͬ�ǽ���Ԫ��֮�����γɼ��Լ���
��4��Ԫ�آܵ�����������Ӧ��ˮ������NaOH���ݵ�����������Ӧ��ˮ������Al��OH��
3�����߷�Ӧ����ƫ�����ƺ�ˮ��
��5����Ԫ�آۺ͢���ɵ�һ�ֻ�������Ԫ�آߵĵ�����ˮ��Һ�з���������ԭ��Ӧ����������ǿ�ᣬ�÷�Ӧ�Ƕ��������������ˮ��Ӧ���������HCl������ʽΪSO
2+Cl
2+2H
2O=H
2SO
4+2HCl�����÷�Ӧת�Ƶ�����ĿΪ2.408��10
23ʱ������n��H
2SO
4��=
| 2.408��1023 | | 6.02��1023/mol |
|
| 2 |
��1=0.2mol��n��HCl��=2n��H
2SO
4��=0.4mol������Hԭ���غ��n��H
+��=n��HCl��+2n��H
2SO
4��=0.4mol+0.4mol=0.8mol���ٸ���C=
����������Ũ�ȣ�
���
�⣺��Ԫ�������ڱ���λ�ã���֪��ΪH����ΪN����ΪO����ΪNa����ΪAl����ΪS����ΪClԪ�أ�
��1����ΪOԪ�أ���ԭ�Ӻ�����2�����Ӳ㡢������������6��ԭ�ӵ��Ӳ���������������ȡ�����Ԫ������������������������ȣ�����OԪ��λ�ڵڶ����ڵ�VIA�壻��ΪSԪ�أ���ԭ�Ӻ�����3�����Ӳ㡢������������6����ԭ�ӽṹʾ��ͼΪ
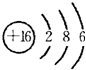
���ʴ�Ϊ���ڶ����ڵ�VIA�壻

��
��2��ͬһ����Ԫ�أ�ԭ�Ӱ뾶����ԭ�������������С�������⼸��Ԫ����ԭ�Ӱ뾶��С����Cl��Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ���ǽ�����Cl��S������Ԫ�آ͢ߵ�����������Ӧ��ˮ��������ǿ��HClO
4��H
2SO
4���ʴ�Ϊ��Cl��HClO
4��H
2SO
4��
��3��Ԫ�آڵ���̬�⻯��Ϊ����������������Nԭ�Ӻ�ÿ��Hԭ�ӹ���һ�Ե��ӣ���Nԭ�ӻ���һ���µ��Ӷԣ������ʽΪ
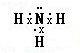
��һ����˵����ͬ�ǽ���Ԫ��֮�����γɼ��Լ��������������д��ڼ��Թ��ۼ����ʴ�Ϊ��
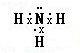
��B��
��4��Ԫ�آܵ�����������Ӧ��ˮ������NaOH���ݵ�����������Ӧ��ˮ������Al��OH��
3�����߷�Ӧ����ƫ�����ƺ�ˮ�����ӷ���ʽΪAl��OH��
3+OH
-=AlO
2-+2H
2O���ʴ�Ϊ��Al��OH��
3+OH
-=AlO
2-+2H
2O��
��5����Ԫ�آۺ͢���ɵ�һ�ֻ�������Ԫ�آߵĵ�����ˮ��Һ�з���������ԭ��Ӧ����������ǿ�ᣬ�÷�Ӧ�Ƕ��������������ˮ��Ӧ���������HCl������ʽΪSO
2+Cl
2+2H
2O=H
2SO
4+2HCl�����÷�Ӧת�Ƶ�����ĿΪ2.408��10
23ʱ������n��H
2SO
4��=
| 2.408��1023 | | 6.02��1023/mol |
|
| 2 |
��1=0.2mol��n��HCl��=2n��H
2SO
4��=0.4mol������Hԭ���غ��n��H
+��=n��HCl��+2n��H
2SO
4��=0.4mol+0.4mol=0.8mol��C��H
+��=
=
=2mol/L��
�ʴ�Ϊ��2mol/L��
���������⿼��Ԫ�����ڱ���Ԫ�������ɣ��漰���ʽṹ�����ӷ���ʽ����д�����ʵ���Ũ�ȵļ����֪ʶ�㣬�����������ʽṹ�����������ǽⱾ��ؼ���ע�����֪ʶ�Ļ��ۣ���Ŀ�ѶȲ���


 ���ʴ�Ϊ���ڶ����ڵ�VIA�壻
���ʴ�Ϊ���ڶ����ڵ�VIA�壻 ��
��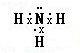 ��һ����˵����ͬ�ǽ���Ԫ��֮�����γɼ��Լ��������������д��ڼ��Թ��ۼ����ʴ�Ϊ��
��һ����˵����ͬ�ǽ���Ԫ��֮�����γɼ��Լ��������������д��ڼ��Թ��ۼ����ʴ�Ϊ��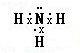 ��B��
��B��

