
【题目】水热法制备![]() 纳米颗粒的总反应为
纳米颗粒的总反应为![]() 下列说法正确的是
下列说法正确的是
A.![]() 、
、![]() 都是氧化剂
都是氧化剂
B.![]()
C.每转移3mol电子,有![]() 被氧化
被氧化
D.氧化产物只有![]()
【答案】C
【解析】
本题考查氧化还原反应的基本概念与计算,![]() 是复杂的化合物,铁元素既有
是复杂的化合物,铁元素既有![]() 价也有
价也有![]() 价,把
价,把![]() 中铁元素的化合价用平均化合价处理,
中铁元素的化合价用平均化合价处理,![]() 的硫元素的化合价用平均化合价处理是解本题的关键,本题难度中等,需细心分析。
的硫元素的化合价用平均化合价处理是解本题的关键,本题难度中等,需细心分析。
在![]() 中,化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化:
中,化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化:![]() ;硫元素的化合价变化为:
;硫元素的化合价变化为:![]() ;氧元素的化合价变化:
;氧元素的化合价变化:![]() ,所以氧化剂是
,所以氧化剂是![]() ;还原剂是
;还原剂是![]() 、
、![]() ,结合离子方程式的电荷守恒原则判断x,据此分析解答。
,结合离子方程式的电荷守恒原则判断x,据此分析解答。
A.由上述分析可知,还原剂是![]() 、
、![]() ,氧化剂是
,氧化剂是![]() ,故A错误;
,故A错误;
B.由电荷守恒可知:![]() ,
,![]() ,故B错误;
,故B错误;
C.由方程式可知,1mol氧气参与反应,转移4mol电子,消耗3mol![]() ,但只有2mol
,但只有2mol![]() 被氧化,所以每转移3mol电子,有1.5mol
被氧化,所以每转移3mol电子,有1.5mol![]() 被氧化,故C正确;
被氧化,故C正确;
D.由上述分析可知,还原剂是![]() 、
、![]() ,则氧化产物有
,则氧化产物有![]() 和
和![]() ,故D错误。
,故D错误。
故选:C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA (气) ![]() bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质A的质量分数增加了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100 mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是 ( )
A. 100 mL的盐酸中HCl的物质的量浓度为7.5 mol·L-1
B. 生成的H2S气体在标准状况下的体积为2.24 L
C. 该磁黄铁矿FexS中,x=0.85
D. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石经处理后得到明矾( KAl(SO4)2·12H2O)。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
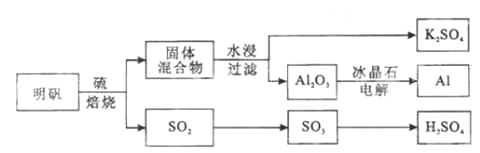
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是__________________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是_____________________。
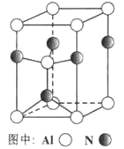
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是____。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是_____________________________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g)![]() 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是__________________________。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2 ②CH3CH2CH=CH2 ③![]() ④CH3CH3
④CH3CH3
A. ①②③④B. ②③C. ②④D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,将下列各组气体分别充入到容积可变的密闭容器中,充分反应后,体积由大到小的顺序是
①2molNH3和1molHCl,②2molSO2和1molO2,③2molH2S和1molSO2,④2molNO和1molO2,⑤1molH2和1mol Cl2
A. ②>④>⑤>①>③
B. ②>⑤>④>①>③
C. ④>②=⑤>③>①
D. ④=⑤>②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
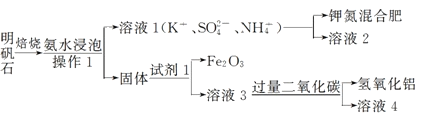
请回答下列问题:
(1)操作l所用到的玻璃仪器的名称是______________________。
(2)由溶液3制取氢氧化铝的离子方程式为__________。
(3)明矾石焙烧时产生SO2气体,请你写出能验证SO2气体具有还原性且实验现象明显的化学方程式________________________。
(4)请你写出验证溶液l中有NH4+的实验过程___________。
(5)实验室用Fe2O3与CO反应来制取单质Fe。
①请你按气流由左到右方向连接下列各装置,顺序为:A→_________________。
②检验装置A气密性的方法是______________________。
③在点燃B处的酒精灯前,应进行的操作是____________________。
④装置C的作用是_________________________。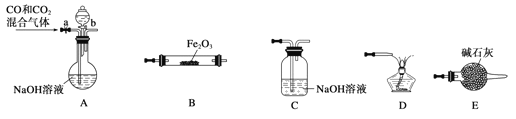
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是
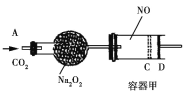
A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备乙酸乙酯的实验装置如图所示:
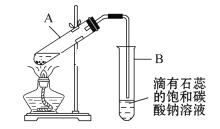
(1)A中浓硫酸的作用是________。
(2)实验时预计试管B中产生的现象有:___、___(答2点)。
(3)欲从试管B中分离出乙酸乙酯,采用的方法是_______(填操作名称);若要对产品乙酸乙酯进行干燥,__(填“能”或“不能”)用碱石灰干燥,理由是______。
(4)写出实验室用乙醇和乙酸制取乙酸乙酯的化学方程式:_______。
(5)若在A中加入4.6 g的乙醇、9.0 g的乙酸、数滴浓硫酸,缓慢加热A至充分反应,最后将产品进行纯化,得乙酸乙酯5.28 g,本实验的产率是________。备注:产率指的是某种生成物的实际产量与理论产量的比值。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com