
【题目】由短周期元素或生活中常见的金属元素组成的中学常见无机物A、B、C、D、E、X存在如下图转化关系(部分生成物和反应条件略去)。下列推断不正确的是
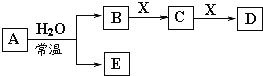
A. 若X是Na2CO3,C为一种温室气体,则A一定是氯气,且D和E不反应
B. 若A是单质,B和D的反应是![]() ,则E一定能还原Fe2O3
,则E一定能还原Fe2O3
C. 若D为CO,C能和E反应,则A一定为![]() ,其电子式
,其电子式![]()
D. 若C的溶液遇KSCN显红色,则A可能为氮的一种氧化物
【答案】A
【解析】
A、X是Na2CO3,C为CO2,当A为NO2,B为HNO3,E为NO,D为NaHCO3也符合转化关系,故A错误;B、根据B、D反应的离子方程式OH-+HCO3-═H2O+CO32-,A为活泼金属Na,B为NaOH、E为H2,X为CO2,C为Na2CO3,D为NaHCO3,H2在加热时能还原Fe2O3,故B正确;C、A为Na2O2,B为O2,E为NaOH,X为C,C为CO2,D为CO,符合转化关系,过氧化钠电子式为,![]() ,故C正确;D、若C的溶液遇KSCN显红色,说明C中含有铁离子,A可能为氮的一种氧化物,如二氧化氮,二氧化氮与水反应生成硝酸和一氧化氮,B为硝酸,E为一氧化氮,硝酸与铁反应生成硝酸铁,则X为铁,D中含有亚铁离子,符合转化关系,故D正确;故选A。
,故C正确;D、若C的溶液遇KSCN显红色,说明C中含有铁离子,A可能为氮的一种氧化物,如二氧化氮,二氧化氮与水反应生成硝酸和一氧化氮,B为硝酸,E为一氧化氮,硝酸与铁反应生成硝酸铁,则X为铁,D中含有亚铁离子,符合转化关系,故D正确;故选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、陶瓷都是硅酸盐产品
③高纯度的硅单质广泛用于制作光导纤维
④普通玻璃是氧化物,成分可表示为SiO2
⑤粗硅制备单晶硅不涉及氧化还原反应
A. ①② B. ①②③ C. ①②③④ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:

(1)含铅废料中的PbO2和PbSO4中,铅的化合价分别为____________、____________。
(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有____________________(任写一种)。
(3)滤液A中含有的主要阳离子是____________________(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为________________________________。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、_________和_________,检验沉淀是否洗涤干净的方法是________________________________。
(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质的分类、名称(或俗名)、化学式都正确的是( )
A.金属氧化物、氧化铁、FeO
B.非金属氧化物、二氧化硫 、SO2
C.碱性氧化物、 过氧化钠 、 Na2O2
D.碱 、 纯碱 、 Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链状有机物M(分子式为C4H6O2)在催化剂作用下可与H2发生加成反应生成有机物N(分子式为C4H8O2),下列有关说法不正确的是(均不考虑立体异构)( )
A. 若M属于羧酸类有机物,则M的结构有3种
B. 若M属于酯类有机物,则M的结构有4种
C. 若M属于羧酸类有机物,则M的加成产物N的结构有2种
D. 若M属于酯类有机物,则M的加成产物N的结构有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,其化学式都可表示为Z2X2Y![]() ,且C的摩尔质量比B大80g/
,且C的摩尔质量比B大80g/![]() ,请回答:
,请回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为_________(填字母代号)
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)下表为B与F实验的部分内容:
①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
②向20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀H2SO4反应的离子方程式______________________;
写出②中反应方程式___________________________。
(3)现由6种粒子![]() (C中含有的阴离子)、
(C中含有的阴离子)、![]() 完成一个离子方程式,已知
完成一个离子方程式,已知![]() 为还原剂,则得到
为还原剂,则得到![]() 需氧化剂的物质的量为_______
需氧化剂的物质的量为_______![]() .
.
(4)化合物D和E相互转化D![]() E,若有D和
E,若有D和![]() 的混合物13.04g,加热到完全反应后,气体产物通过浓
的混合物13.04g,加热到完全反应后,气体产物通过浓![]() 增重3.42g,剩余气体通过碱石灰增生2.20g,则
增重3.42g,剩余气体通过碱石灰增生2.20g,则![]() 的化学式为__________________________.
的化学式为__________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应表达正确的是( )
A. 1-丙醇与浓氢溴酸反应: CH3CH2 CH2OH + HBr ![]() CH3CH2 CH2Br + H2O
CH3CH2 CH2Br + H2O
B. 服用阿司匹林过量出现水杨酸(![]() )中毒反应, 可静脉注射 NaHCO3溶液:
)中毒反应, 可静脉注射 NaHCO3溶液:
![]() + 2 HCO3-→
+ 2 HCO3-→![]() + 2 CO2↑ + 2 H2O
+ 2 CO2↑ + 2 H2O
C. 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-![]() CH2BrCOO-+H2O
CH2BrCOO-+H2O
D. 向丙氨酸钠中加入足量盐酸: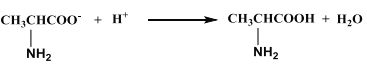
查看答案和解析>>
科目:高中化学 来源: 题型:
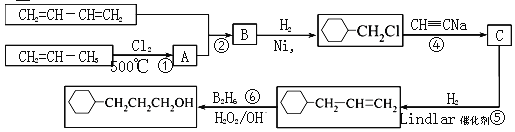
【题目】工业上以1,3-丁二烯,丙烯,乙炔等为原料合成![]() 流程图如下
流程图如下
已知:有机反应中有一种双烯加成反应,如:CH2=CH—CH=CH2+CH2=CH2→ 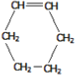 。
。
(1)反应①的反应类型是______________,B中含有的官能团的名称________________。
(2)写出反应②的化学方程式__________________________。
(3)写出C的结构简式_______________。
(4)写出![]() 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式__________。
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式__________。
(5)根据以上合成信息,以乙烯为原料合成1,6—己二醇,其他试剂任选,写出合成的流程图________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com