
����Ŀ���� ��MnO2��Zn�Ĺ��ռ�������ͼ��ʾ(�м����Ĺ��岿���Ѿ���ȥ):
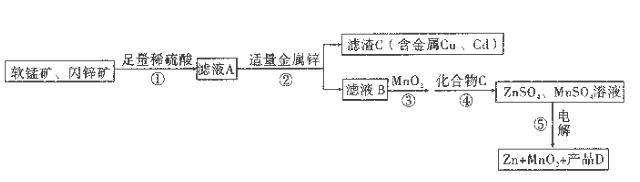
���̿�: MnO2������65%��Al2O3����Ϊ4%����п��: ZnS������80%�� FeS��CuS��CdS������Ϊ2%�� ��ҺB�к���������: Zn2+��Mn2+�� Fe2+��Al3+��
�Իش���������:
��1������������̿���п����������Һ����ʱ���������ҽ���Ԫ��ת��Ϊ��Ӧ��������(��Ԫ����+3�۴���)�� ����MnO2��FeS���������ӷ���ʽΪ___________________________��
��2������� �е�MnO2Ҳ��������___________________���ʴ���(������Mn2+�ķ�Ӧ)
A.KMnO4 ���� B.H2O2 C.Ũ���� D.������ˮ
��3�� ����ݵ������������ĵ缫��ӦʽΪ___________________________��
��4�����뻯����C��ɵô�����ZnSO4 ��MnSO4��Һ��C������ZnO��Zn(OH)2��Mn (OH)2 ��MnCO3,
���ƷDΪ___________________________(�ѧʽ)��
��5��I .���Ƶõ�MnO2(s)��KOH(s)��KClO3(s)(��������ϣ���������(���Ͻ���)�ɵ�KCl��K2MnO4�Ĺ������
II.����5%��KOH��Һ�ܽ����ɫ(MnO42-)��Һ��
III.����ɫ��Һ��ͨ��������CO2����Һ���ȣ���������ȥ����( ��MnO2(s)]��
IV.����Һ����Ũ������ȴ��Ʒ�����ˡ�ϴ�ӡ��������ɫKMnO4���塣
�ٵ�III�������������ȹ�������Ŀ����___________________________��
�� д��III������KMnO4�Ļ�ѧ��ʽ__________________________________��
��III�������CO2����������CO2��������ʹ���ò�Ʒ�Ĵ��Ƚ��ͣ�ԭ�������___________________
���𰸡� 3MnO2+2FeS+12H+![]() 2Fe3++3Mn2++2S+6H2O B Mn2+-2e-+2H2O=MnO2+4H+ H2SO4 ��ֹ�¶Ƚ��ͣ�KMnO4 ���������²����½� 2CO2+3K2MnO4
2Fe3++3Mn2++2S+6H2O B Mn2+-2e-+2H2O=MnO2+4H+ H2SO4 ��ֹ�¶Ƚ��ͣ�KMnO4 ���������²����½� 2CO2+3K2MnO4![]() 2KMnO4+MnO2��+2K2CO3 ͨ�����CO2�������ܽ��С��KHCO3����KMnO4����һ������
2KMnO4+MnO2��+2K2CO3 ͨ�����CO2�������ܽ��С��KHCO3����KMnO4����һ������
�������������������1������������MnO2��FeS��Ӧ����S��MnSO4��Fe2(SO4)3����2��������е�MnO2����������Fe2+����ΪFe3+��Ϊ�����������ʣ�������H2O2����MnO2����3������ݵ�������MnSO4��ZnSO4����Zn��MnO2������ʧ���ӷ���������Ӧ����4�����뻯����C��ɵô�����ZnSO4��MnSO4��Һ ��������Ӧʽ��Mn2+-2e-+2H2O=MnO2+4H+�����Բ�ƷDΪH2SO4����5�����¶Ƚ��ͣ�KMnO4 �ܽ�ȼ�С�������� III��CO2��K2MnO4��Ӧ����KMnO4��MnO2��K2CO3����III����CO2�������������ܽ��С��KHCO3��
��������1������������MnO2��FeS��Ӧ����S��MnSO4��Fe2(SO4)3����Ӧ���ӷ���ʽ��3MnO2+2FeS+12H+![]() 2Fe3++3Mn2++2S+6H2O����2��������е�MnO2����������Fe2+����ΪFe3+��Ϊ�����������ʣ�������H2O2����MnO2����3������ݵ�������MnSO4��ZnSO4����Zn��MnO2������ʧ���ӷ���������Ӧ������������Ӧʽ��Mn2+-2e-+2H2O=MnO2+4H+����4�����뻯����C��ɵô�����ZnSO4��MnSO4��Һ ��������Ӧʽ��Mn2+-2e-+2H2O=MnO2+4H+�����Բ�ƷDΪH2SO4����5���ٵ�III�������������ȹ�������Ŀ���Ƿ�ֹ�¶Ƚ��ͣ�KMnO4 ���������²����½����� III��CO2��K2MnO4��Ӧ����KMnO4��MnO2��K2CO3����Ӧ����ʽ��2CO2+3K2MnO4
2Fe3++3Mn2++2S+6H2O����2��������е�MnO2����������Fe2+����ΪFe3+��Ϊ�����������ʣ�������H2O2����MnO2����3������ݵ�������MnSO4��ZnSO4����Zn��MnO2������ʧ���ӷ���������Ӧ������������Ӧʽ��Mn2+-2e-+2H2O=MnO2+4H+����4�����뻯����C��ɵô�����ZnSO4��MnSO4��Һ ��������Ӧʽ��Mn2+-2e-+2H2O=MnO2+4H+�����Բ�ƷDΪH2SO4����5���ٵ�III�������������ȹ�������Ŀ���Ƿ�ֹ�¶Ƚ��ͣ�KMnO4 ���������²����½����� III��CO2��K2MnO4��Ӧ����KMnO4��MnO2��K2CO3����Ӧ����ʽ��2CO2+3K2MnO4![]() 2KMnO4+MnO2��+2K2CO3����III����CO2�������������ܽ��С��KHCO3����KMnO4����һ��������ʹ���ò�Ʒ�Ĵ��Ƚ�����
2KMnO4+MnO2��+2K2CO3����III����CO2�������������ܽ��С��KHCO3����KMnO4����һ��������ʹ���ò�Ʒ�Ĵ��Ƚ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10�֣���һ��������þ���Ͻ�Ͷ��100 mLһ��Ũ�ȵ������У��Ͻ���ȫ�ܽ⡣��������Һ�еμ�Ũ��Ϊ5 mol/L��NaOH��Һ�����ɵij����������NaOH��Һ�������ϵ��ͼ���������������λ��mL��������������λ��g����
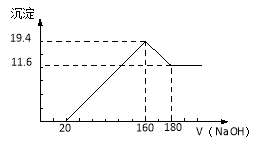
(1)�Ͻ���Mg������.
(2)����HCl�����ʵ���Ũ��.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£����һ�����ܱ������н��з�Ӧ��![]()
![]() �����з�����ȷ����
�����з�����ȷ����
A. ƽ������![]() ���÷�Ӧ��
���÷�Ӧ��![]() ����
����
B. ƽ��������¶ȣ�ƽ�ⳣ��K���
C. ƽ����ٳ���![]() ���ﵽ��ƽ��ʱ��
���ﵽ��ƽ��ʱ�� ![]() �İٷֺ������
�İٷֺ������
D. ����Ӧǰ�����![]() ��
��![]() ���ʵ�����ȣ���ƽ��ʱ
���ʵ�����ȣ���ƽ��ʱ![]() ��ת���ʱ�
��ת���ʱ�![]() �ĸ�
�ĸ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ⶨһƿ������ֻ����C,O����Ԫ�أ���ƿ���岻�����ǣ� ��
A.һ�ֻ�����
B.��������������
C.���ֻ�����
D.һ�ֵ��ʺ�һ�ֻ�����Ļ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���±������˵����ȷ����
A����������(CH3CH2Br)�����У���Ԫ�صĴ�����ʽΪ������
B����±�����У�±��ԭ����̼ԭ���γɹ��ۼ�
C�����ķ���ϩ(������)Ϊ�߷��ӻ����������±����
D��±��������Ӧ�������ķе��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ�úʹ������Ļ��������������������Ҫ���塣
��1������[CO(NH2)2]��һ�ָ�Ч���ʣ�Ҳ��һ�ֻ���ԭ�ϡ�
��������Ϊԭ����һ�������·�����Ӧ��CO(NH2)2 (s) + H2O(l)![]() 2 NH3(g)+CO2(g) ��H��+133.6 kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽK�� �����ڸ÷�Ӧ������˵����ȷ���� ������ţ���
2 NH3(g)+CO2(g) ��H��+133.6 kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽK�� �����ڸ÷�Ӧ������˵����ȷ���� ������ţ���
a. �ӷ�Ӧ��ʼ��ƽ��ʱ�����л�������ƽ����Է����������ֲ���
b. ��ƽ����ϵ������ˮ��������ʹ�÷�Ӧ��ƽ�ⳣ������
c. �����¶�ʹ���ص�ת��������
��������һ�������¿ɽ����������ﻹԭΪ������
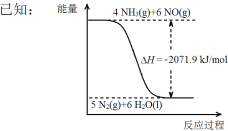
��Ϣ�����Ϣ�����ػ�ԭNO(g)���Ȼ�ѧ����ʽ�� ��
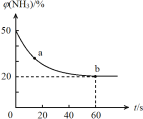
���ܱ��������Ե����ʵ�����NH3��CO2Ϊԭ������120 �桢���������·�Ӧ�������أ�CO2(g) +2NH3(g)![]() CO (NH2)2 (s) +H2O(g)�����������NH3�����ʵ����ٷֺ���[�գ�NH3��]��ʱ��仯��ϵ��ͼ��ʾ����a�������Ӧ����v����CO2�� b����淴Ӧ����v���棩��CO2�����>������=����<������������ƽ��ת������ ��
CO (NH2)2 (s) +H2O(g)�����������NH3�����ʵ����ٷֺ���[�գ�NH3��]��ʱ��仯��ϵ��ͼ��ʾ����a�������Ӧ����v����CO2�� b����淴Ӧ����v���棩��CO2�����>������=����<������������ƽ��ת������ ��
��2��NO2����Ⱦ����������Na2CO3��Һ����NO2������CO2����֪9.2 g NO2��Na2CO3��Һ��ȫ��Ӧʱת�Ƶ���0.1 mol���˷�Ӧ�����ӷ���ʽ�� ��ǡ�÷�Ӧ��ʹ��Һ�е�CO2��ȫ�ݳ���������Һ�������ԣ�����Һ�д��ڵ���������Ũ�ȴ�С��ϵ��c(Na+)>________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ��п�ɳ���طŵ�ʱ�缫��������ת����ʾ��ͼ�����ʹ��KOH��K2Zn(OH)4Ϊ�������Һ�����й��ڸõ��˵����ȷ���ǣ� ��

A. �ŵ�ʱ��Һ�е�K+���� B. ���ʱ����������pH�ή��
C. �ŵ�ʱ������ӦΪH++NiOOH+e-=Ni(OH)2 D. ��������ÿ����6.5g��Һ��������6.3g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�ΪV L���ܱ������н��з�Ӧ��aN��g��![]() bM��g����M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ��
bM��g����M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ��
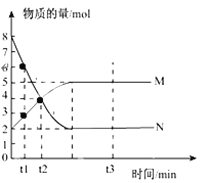
��1���˷�Ӧ��ѧ����ʽ��![]() =_________��
=_________��
��2��t1��t2ʱ�̣���N��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ��___________________��
��3��Ϊ��߷�Ӧ����,���Բ�ȡ________��_______�ȿ��еĴ�ʩ����֪�÷�Ӧ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ�ѧ����������ȷ����
A.���ӻ�������ֻ�������Ӽ�
B.�ǽ���Ԫ����ɵĻ������п��ܴ������Ӽ�
C.�ɲ�ͬ��Ԫ����ɵĶ�ԭ�ӷ����һ��ֻ���ڼ��Թ��ۼ�
D.������Ԫ�صĻ�������һ���������Ӽ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com