
| A、1:1:1 |
| B、1:2:3 |
| C、2:1:1 |
| D、3:2:1 |
| 2mol |
| 2 |


科目:高中化学 来源: 题型:
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500 s 内N2O5分解速率为2.96╳10-3mol?L-1?s-1 |
| B、达平衡时,N2O5的转化率为50% |
| C、达平衡后,升高温度平衡常数减小 |
| D、达平衡后,其他条件不变,将容器的体积压缩到原来的一半,c(N2O5)>5.00 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | |
| 丙 | 丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、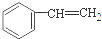 没有顺反异构体 没有顺反异构体 |
| B、1,3-丁二烯可以作为合成高分子化合物的原料 |
| C、用乙醇和浓硫酸制备乙烯时,用水浴加热控制反应温度 |
| D、常温下,将苯酚加入到少量水中有浑浊,滴入适量NaOH溶液后浑浊消失 |
E、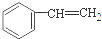 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.21mol |
| B、0.25mol |
| C、0.45mol |
| D、0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的电离过程是吸热过程 |
| B、c(H+)随着温度的降低而升高 |
| C、在35℃时,纯水中c(H+)>c(OH-) |
| D、水的电离度α(25℃)>α(35℃) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com