
【题目】化学是一门以实验为基础的学科,下列关于高中课本中的实验说法正确的是
A. 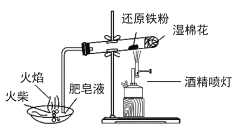 铁与水蒸气反应,湿棉花可以为反应提供原料
铁与水蒸气反应,湿棉花可以为反应提供原料
B. 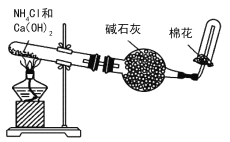 实验室制氨气,干棉花可以吸收多余的氨气以免污染环境
实验室制氨气,干棉花可以吸收多余的氨气以免污染环境
C.  实验室制乙酸乙酯,m试管中物质只有乙醇、浓硫酸和乙酸
实验室制乙酸乙酯,m试管中物质只有乙醇、浓硫酸和乙酸
D. 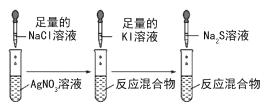 沉淀溶解转化实验,不能用来说明Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S)
沉淀溶解转化实验,不能用来说明Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S)
【答案】A
【解析】
A. 铁与水蒸气反应,湿棉花在加热试管时的余热作用下产生水蒸气,可以为反应提供原料;
B. 实验室制氨气,干棉花不能吸收多余的氨气;
C. 实验室制乙酸乙酯,m试管中物质有乙醇、浓硫酸、乙酸和乙酸乙酯;
D. 沉淀溶解转化实验,NaCl、KI均为足量,可以完全反应生成相应的沉淀,能用来说明Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S)。
A. 铁与水蒸气反应,湿棉花在加热试管时的余热作用下产生水蒸气,可以为反应提供原料,A正确;
B. 实验室制氨气,干棉花不能吸收多余的氨气,B错误;
C. 实验室制乙酸乙酯,m试管中物质有乙醇、浓硫酸、乙酸和乙酸乙酯,C错误;
D. 沉淀溶解转化实验,NaCl、KI均为足量,可以完全反应生成相应的沉淀,能用来说明Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S),D错误;
答案为A。


科目:高中化学 来源: 题型:
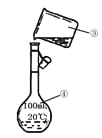
【题目】化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:
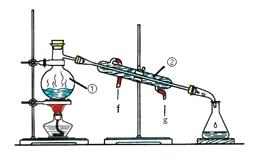
I II
(1)写出上述图中仪器的名称:①_______;②______;
(2)若利用装置I分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有__________,将仪器补充完整后进行的实验操作的名称为_____;实验时仪器②中冷却水的进口为_______(选填“f”或“g”)。
(3)现需配制250 mL 0.2 mol·L-1 NaCl溶液,装置II是某同学转移溶液的示意图,图中有两处错误分别是_______,_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表:

下列离子方程式正确的是( )
A. 少量CO2通入NaClO溶液中:CO2 + H2O + 2ClO-===CO32-+ 2HClO
B. 少量的SO2通入Ca(ClO)2溶液中:SO2 + H2O + Ca2+ + 2ClO-===CaSO3↓+2HClO
C. 少量的SO2通入Na2CO3溶液中:SO2 + H2O + 2CO32-===SO32-+ 2HCO3-
D. 相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H+ + HCO3-===CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是 ( )
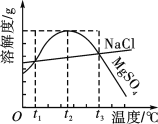
A. 只有在t1 ℃时,NaCl和MgSO4的溶解度才相等
B. t1~t2 ℃,MgSO4的溶解度随温度升高而减小
C. 在t2 ℃时,MgSO4饱和溶液的溶质质量分数最大
D. 把MgSO4饱和溶液的温度从t3 ℃降至t2 ℃时,有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卫生部严令禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。过氧化钙(CaO2)常用作杀菌剂、防腐剂,是一种白色固体,带有结晶水,通常还含有CaO。
I、制备过氧化钙。
某实验小组选用如下装置制备过氧化钙。已知化学反应Ca2++H2O2+2NH3+xH2O===CaO2·xH2O↓+2NH4+。在碱性环境中制取CaO2·xH2O的装置如下图:
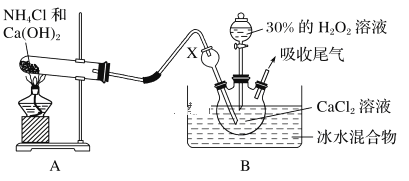
(1)装置B中仪器X的作用是_____________;反应在冰水浴中进行的原因是_________________。
(2)反应结束后,经________、________、低温烘干获得CaO2·xH2O。
II、含量测定。
(1)称取13.52 g过氧化钙样品,灼热时发生如下反应:2[CaO2·xH2O]→2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为____________。
(2)另取同一样品13.52 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 7.0 g。样品中杂质CaO的质量为_____________;样品CaO2·xH2O中的x值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。

(1)常温下,FeCl3溶液的pH____7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
①甲同学认为步骤Ⅰ中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因______________
②乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:__________
![]() Fe3++
Fe3++![]() SO
SO![]() +
+![]() ________——
________——![]() Fe2++
Fe2++![]() ________+
________+![]() ________
________
乙同学查阅资料得知:
ⅰ.Fe2+与![]() 反应生成墨绿色的絮状沉淀FeSO3
反应生成墨绿色的絮状沉淀FeSO3
ⅱ.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:

甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是____。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:

①经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是________(填字母)。
a.K3[Fe(CN)6]溶液 b.KSCN溶液 c.KMnO4溶液
②已知H2SO3是弱酸,请结合电离方程式说明步骤Ⅲ中出现红褐色的原因:_____________
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种新型的乙醇电池,它用磺酸类质子溶剂,在200 ℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为C2H5OH+3O2===2CO2+3H2O,电池示意如图,下列说法不正确的是( )

A. a极为电池的负极
B. 电池工作时,电流由b极沿导线经灯泡再到a极
C. 电池正极的电极反应为4H++O2+4e-===2H2O
D. 电池工作时,1 mol乙醇被氧化时就有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种药物中间体,合成 G的部分流程如下:

请回答下列问题:
(1)G物质中的含氧官能团的名称是___________、____________。
(2)上述⑤变化过程的反应类型是_____________。
(3)反应A→B的化学方程式为________________________________________。
(4)写出满足下列条件的C的同分异构体的结构简式:_______________________。
Ⅰ. 苯环上只有两种取代基。
Ⅱ. 分子中只有4种不同化学环境的氢。
Ⅲ. 能与NaHCO3反应生成CO2。
(5)根据已有知识并结合相关信息,写出以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备![]() 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH__________
CH3CH2OH__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com