
【题目】氨气常用作合成氯氨类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHCl2和NCl3),副产物少于其它水消毒剂。
回答下列问题:
(1)工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的键能相同),则该反应的△H=___kJ/mol。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生完全水解,生成具有强烈杀菌消毒作用的物质,该水解反应的化学方程式为___。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)。在恒温条件下,3molCl2和1molNH3发生反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(g)+2HCl(g)。在恒温条件下,3molCl2和1molNH3发生反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
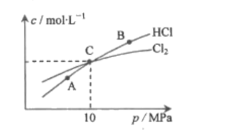
①A、B、C三点中Cl2转化率最高的是___点(填“A”“B”或“C")。
②计算C点时该反应的压强平衡常数Kp(C)=____(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图),总反应为:CO(NH2)2+H2O![]() 3H2↑+N2↑+CO2↑。
3H2↑+N2↑+CO2↑。
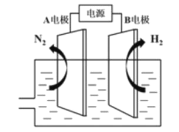
①A电极连接电源的___极(填"正”或“负”)。
②A电极的电极反应为___。
【答案】+11.3kJ/mol NH2Cl+H2O=NH3+HClO B 3 正 CO(NH2)2-6e-+H2O=CO2↑+N2↑+6H+
【解析】
(1)△H等于反应物的总键能减去生成物的总键能;一氯胺的水解属于两物质之间交换成分的复分解反应,据此可写化学方程式;
(2)①Cl2转化率最高点就是图中Cl2含量最低、HCl含量最高的点;
②要计算C点时该反应的压强平衡常数Kp(C),按起始物质的量,用三段式计算出平衡时各成分的物质的量,再按信息计算(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数);
(3)按电解总反应为:CO(NH2)2+H2O![]() 3H2↑+N2↑+CO2↑分析,尿素是还原剂被氧化,它发生反应的A电极就是阳极,所连就是的电源正极,A电极上就是尿素被氧化的反应;
3H2↑+N2↑+CO2↑分析,尿素是还原剂被氧化,它发生反应的A电极就是阳极,所连就是的电源正极,A电极上就是尿素被氧化的反应;
(1)△H等于反应物的总键能减去生成物的总键能;对于反应Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g),△H=243.0+3×391.3-(2×391.3+191.2+431.8)=+11.3kJ/mol
答案为:+11.3kJ/mol;
一氯胺的水解属于两物质之间交换成分的复分解反应,则化学方程式为NH2Cl+H2O=NH3+HClO;
答案为:NH2Cl+H2O=NH3+HClO;
(2)①Cl2转化率最高点就是图中Cl2含量最低、HCl含量最高的B点;
答案为:B;
②计算C点时反应2Cl2(g)+NH3(g) ![]() NHCl2(g)+2HCl(g)的压强平衡常数Kp(C),
NHCl2(g)+2HCl(g)的压强平衡常数Kp(C),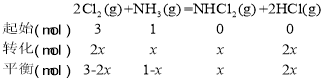
因为C点氯气和氯化氢等量,所以3-2x=2x,x=0.75mol,气体总物质的量为3-2x+1-x+x +2x=4mol,总压强为10MPa,按定义计算Kp,![]()
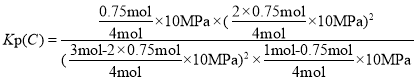 =3
=3
答案为:3;
(3)按电解总反应为:CO(NH2)2+H2O![]() 3H2↑+N2↑+CO2↑分析,尿素是还原剂被氧化,它发生反应的A电极就是阳极,A所连就是的电源正极,
3H2↑+N2↑+CO2↑分析,尿素是还原剂被氧化,它发生反应的A电极就是阳极,A所连就是的电源正极,
答案为:正;
A电极上就是尿素被氧化的反应;由图知,氧化产物为N2,则电极反应式为:CO(NH2)2-6e-+H2O=CO2↑+N2↑+6H+;
答案为:CO(NH2)2-6e-+H2O=CO2↑+N2↑+6H+。


科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是 ( )
A.铁和稀硝酸反应制得浅绿色溶液:Fe + 4H + + NO 3-![]() Fe 3+ + NO↑+ 2H 2O
Fe 3+ + NO↑+ 2H 2O
B.向Ca(ClO) 2溶液中通入过量CO 2制取次氯酸:2ClO-+ H 2O + CO 2 ![]() 2HClO + CO 32-
2HClO + CO 32-
C.向酸性KMnO 4溶液中通入SO 2:2MnO 4-+5SO 2+4OH -=2Mn 2++5SO 42-+2H 2O
D.硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH﹣+Cu2++SO42﹣=BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物:
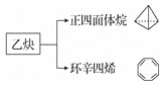
下列说法正确的是( )
A.正四面体烷的分子式为C4H8B.正四面体烷二氯取代产物有1种
C.环辛四烯核磁共振氢谱有2组峰D.环辛四烯与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中含锰元素的主要矿物有软锰矿(MnO2·xH2O)、黑锰矿Mn3O4,大洋底部有大量锰结核矿。锰元素在多个领域中均有重要应用,用于制合金,能改善钢的抗冲击性能等。
(1)Mn在元素周期表中位于___区,核外电子占据最高能层的符号是___,金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用“___理论”解释。
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是___。
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn2+中不含成对电子
C.第四周期元素中,锰原子价电子层中未成对电子数最多
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为__。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__。
(4)二价锰的化合物MnO和MnS熔融态均能导电,熔点MnO___MnS(选填“高于”、“等于”、“低于”)并解释原因___。
(5)某锰氧化物的晶胞结构如图:
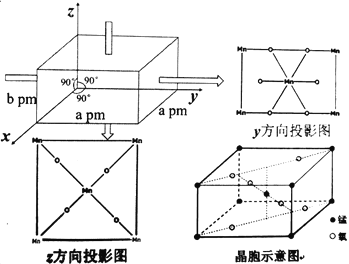
该锰的氧化物的化学式为___,该晶体中Mn的配位数为____,该晶体中Mn之间的最近距离为___pm(用a、b来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学对提高人类生活质量和促进社会发展具有重要作用。下列说法正确的是( )
A.某些金属元素的焰色反应、海水提溴、煤的气化、石油的裂化都是化学变化的过程
B.氮氧化物的大量排放,会导致光化学烟雾、酸雨和温室效应等环境问题
C.油脂的主要成分是高级脂肪酸甘油酯,长时间放置的油脂会因水解而变质
D.白葡萄酒含维生素C等多种维生素,通常添加微量![]() 的目的是防止营养成分被氧化
的目的是防止营养成分被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I(C31H34O6)的合成路线如图:
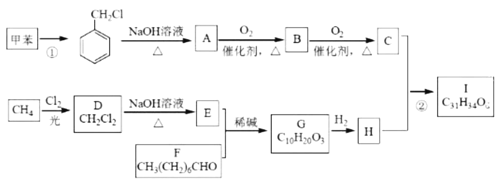
已知: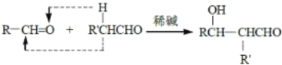 、
、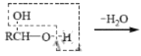 RCHO
RCHO
回答下列问题:
(1)②的反应类型是___。
(2)G的结构简式为___。
(3)①写出A→B的化学方程式为___。
②写出E和新制氢氧化铜溶液反应的化学方程式___。
③写出B与银氨溶液反应的离子方程式___。
(4)若某化合物W的相对分子质量比化合物C大14,且满足下列条件,则W的可能结构有___种。
①遇到FeCl3溶液显色 ②属于芳香族化合物 ③能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
A.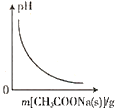 图表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
图表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.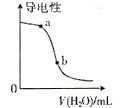 图表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a点>b点
图表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a点>b点
C.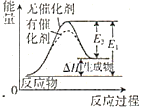 图表示催化剂能改变化学反应的焓变
图表示催化剂能改变化学反应的焓变
D. 图表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
图表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在地壳中的含量较高,在自然界中硅主要以硅的氧化物和硅酸盐的形式存在。高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。下图为一种工业上提纯硅的路线:
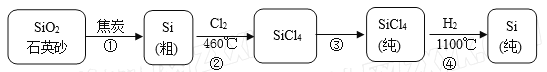
相关信息如下:
a.硼、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | FeCl3 | PCl5 | Si | SiH4 |
沸点/℃ | 57.7 | 12.8 | 315 | — | 2355 | -111.9 |
熔点/℃ | -70.0 | -107.2 | — | — | 1410 | — |
升华温度/℃ | — | — | 300 | 162 | — | — |
请回答下列问题:
(1)SiCl4的电子式:________________;
(2)写出①的化学方程式________________________________________;
(3)①SiO2是硅酸盐玻璃的主要成分,盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,写出发生反应的离子方程式 ______________________________________________________________
②硅能与NaOH溶液反应,但同主族元素金属锗(Ge)不易溶于NaOH溶液,但有H2O2存在时,锗能与NaOH溶液反应生成锗酸盐,请写出化学反应方程式 ______________________________________________________________
(4)用强还原剂LiAlH4在乙醚介质中还原SiCl4,制得高纯度的甲硅烷SiH4,SiH4极易水解生成SiO2·nH2O和另一种气体。写出SiH4水解的化学反应方程式 __________________________________________________________________
(5)下列有关含硅材料说法正确的是_______________ (填字母)
A. 沸点:SiCl4 > SiH4
B. 金刚砂的有效成分是氮化硅,硬度大、熔点高,可用于制作高温陶瓷和轴承
C. 玻璃、陶瓷、水泥是广泛使用的三大新型硅酸盐材料
D. 人工制造的分子筛(一种具有均匀微孔结构的铝硅酸盐),主要用作吸附剂和催化剂等。
E. 锗、锡、铅的+4价氢氧化物的碱性强弱顺序:Ge(OH)4 < Sn(OH)4 < Pb(OH)4
6)粗硅中常含有铁、硼、磷等杂质,步骤②需在无氧无水环境下,控制温度在460℃左右得到SiCl4粗品,欲提纯SiCl4,步骤③采用的工艺方法依次是沉降、冷凝和_____________,需收集温度在_________℃左右的馏分。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性溶液中只有Na+、CH3OOO-、H+、OH-四种离子。则下列描述正确的是
A.该溶液可由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
B.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
C.加入NaOH,溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com