
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。

回答下列问题:
(1)A中加入的物质是_______,发生反应的化学方程式是________________________。
(2)B中加入的物质是____________,其作用是_________________。
(3)实验时在C中观察到得现象是_______,发生反应的化学方程式是________________。
(4)实验时在D中观察到得现象是____________________,D中收集到的物质是_____________,检验该物质的方法和现象是______________________。
【答案】固体NH4Cl和Ca(OH)2 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 碱石灰(或CaO) 除去NH3中的水蒸气 黑色粉末部分逐渐变为红色 2NH3+3CuO
CaCl2+2NH3↑+2H2O 碱石灰(或CaO) 除去NH3中的水蒸气 黑色粉末部分逐渐变为红色 2NH3+3CuO![]() N2+3H2O+3Cu 出现无色液体 氨水 用红色石蕊试纸检验,试纸变蓝(或用无水CuSO4检验,无水CuSO4变蓝)
N2+3H2O+3Cu 出现无色液体 氨水 用红色石蕊试纸检验,试纸变蓝(或用无水CuSO4检验,无水CuSO4变蓝)
【解析】
根据实验目的:氨与灼热的氧化铜反应得到氮气和金属铜,所以A处是产生氨气的反应,用氯化铵和氢氧化钙来制取氨气,氨气中混有水蒸气,用碱石灰干燥,氨气易液化,极易吸收水成为氨水,氨水具有碱性,能使红色石蕊试纸变蓝,其中的结晶水会使无水硫酸铜变蓝。
(1)根据实验目的:氨与灼热的氧化铜反应得到氮气和金属铜,可知A中加入的是氯化铵和氢氧化钙的固体混合物,加热来制取氨气,发生反应的化学方程式是:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,
CaCl2+2NH3↑+2H2O,
故答案为:固体NH4Cl和Ca(OH)2;2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O ;
CaCl2+2NH3↑+2H2O ;
(2)制得的氨气中含有杂质水,可以用碱石灰来吸收,
故答案为:碱石灰;除去氨气中的水蒸气;
(3)氨气和氧化铜在加热的条件下发生反应生成金属铜、水以及氮气,黑色粉末逐渐变为红色,
故答案为:黑色粉末逐渐变为红色;2NH3+3CuO![]() N2+3H2O+3Cu;
N2+3H2O+3Cu;
(4)氨气还原氧化铜之后剩余的氨气和产生的水蒸气在冷凝时会形成氨水,具有氨气分子和结晶水的成分,氨水可以使使红色石蕊试纸变蓝,其中的结晶水会使无水硫酸铜变蓝,
故答案为:出现无色液体;氨水;用红色石蕊试纸检验,试纸变蓝(或用无水硫酸铜检验,无水硫酸铜变蓝)。


科目:高中化学 来源: 题型:
【题目】1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda﹣style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )
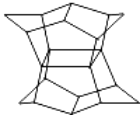
A. 分子式为C20H20
B. 一氯代物的同分异构体只有两种
C. 分子中含有二个亚甲基(﹣CH2﹣)
D. 分子中含有4个五元碳环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证铜与稀硝酸反应的还原产物是NO而不是NO2,设计了如下图的装置,以下叙述错误的是
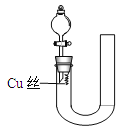
A. 应先打开活塞再从右侧加稀硝酸
B. 左侧稀硝酸须注满
C. 关闭活塞后铜丝会全部溶解
D. 反应停止后打开活塞气体变成红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是( )
A. 化合反应和复分解反应不可能是氧化还原反应
B. 阳离子只能得到电子被还原,阴离子只能失去电子被氧化
C. 含有最高价元素的化合物不一定具有很强的氧化性
D. 在氧化还原反应中肯定有一种元素被氧化,另一种元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅丹(Pb3O4)可作防锈用涂料,已知铅丹中Pb元素的化合价只有+2、+4,且+2价稳定,+4价的Pb具有强氧化性,能氧化浓盐酸生成Cl2。则下列说法不正确的是 ( )
A. Pb3O4可表示为2PbO·PbO2
B. 可用PbO在空气中加热制备铅丹,其n(氧化剂):n(还原剂)=1:6
C. 0.1mol Pb3O4与足量的浓盐酸反应,生成Cl20.1 mol
D. a mol Pb3O4加强热分解生成PbO,则加热过程中转移电子数为2a NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。
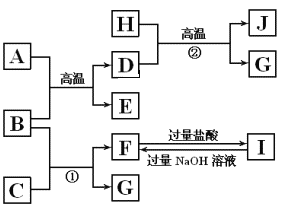
根据图示回答问题:
(1)写出下列物质的化学式:A ______,E______;
(2)反应①的化学方程式是_________________________ ;
反应②的化学方程式是___________________________ ;
(3)J与盐酸反应的化学方程式是______________________ ;
反应后的溶液与足量的D反应的离子方程式是______________________,如何检验最后溶液中的阳离子:______________________________________。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1mol·L1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
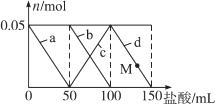
A. a曲线表示的离子方程式为:AlO2-+H++H2O===Al(OH)3↓
B. b和c曲线表示的离子反应是相同的
C. M点时,溶液中沉淀的质量为3.9g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH 的变化如图所示,下列叙述错误的是

A. 向pH=5 的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH= 4时,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 时,溶液中主要含铁型体浓度的大小关系为 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是
A. 6.0gSiO2中含有0.1NA个SiO2分子
B. 标准状况下,向1L密闭容器中充入46gNO2气体,容器中的分子数为NA
C. 过氧化钠与水反应,每生成0.1mol氧气,转移电子的数目为0.4NA
D. 常温常压下,7.0g由丁烯与丙烯组成的混合物中含有氢原子的数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com