
����Ŀ������ij��̼�Ͻ�ij��ѧ��ȤС��Ϊ�˲ⶨ��̼�Ͻ�������������������̽��Ũ�����ijЩ���ʣ��������ͼ��ʾ��ʵ��װ�ú�ʵ�鷽�����г�������ʡ�ԣ����������������ش���Ӧ����(��ʵ��װ�������ʵ�������Բ���)��
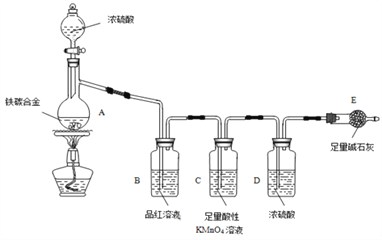
I��̽��Ũ�����ijЩ����
��1����ͼʾ����װ�ã����װ��___________������E��������
��2����a����̼�Ͻ���Ʒ����A�У��ټ���������Ũ���ᣬ����A������Ϊ______��δ��ȼ�ƾ���ǰ��A��B ��������������ԭ����______________________��
��3����ȼ�ƾ���һ��ʱ���A��B�пɹ۲쵽���Ե�������A��![]() ��д��A��C��Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽ��__________________________��B�е�������_________________����˿ɵõ�Ũ�������_____________�ԡ�
��д��A��C��Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽ��__________________________��B�е�������_________________����˿ɵõ�Ũ�������_____________�ԡ�
��4�����ŷ�Ӧ�Ľ��У�Ũ����Ũ����С��Ϊϡ���ᣬA�л����ܷ���ijЩ���ӷ�Ӧ��д����Ӧ�����ӷ���ʽ��_________________��____________________��
II���ⶨ������������
��5����A�й�����ȫ��ʧ�������ݳ�����ʱ��ֹͣ���ȣ�����E�����أ�E����bg����̼�Ͻ���������������Ϊ___________________(д����ʽ)��
��6��ijͬѧ��Ϊ���������ϸ��ӣ�ʹ����ͼ��ʾ��װ�ú��������õ�ʵ�������ⶨijЩ���ݼ��ɡ�Ϊ�˿��ٺ�ȷ�ؼ�����������������������ʵ�������___________����д���ţ���

������ˮ���ⶨH2�����
�ڷ�Ӧ�������ˡ�ϴ�ӡ������������������
�� �ⶨ��Ӧǰ��װ�ú�ҩƷ��������ag
���𰸡������� ������ƿ �����£�����Ũ����ۻ� C��2H2SO4��Ũ��![]() CO2����2SO2����2H2O Ʒ����Һ����ɫ ǿ���� 2Fe3����Fe=3Fe2�� Fe��2H��=Fe2����H2��
CO2����2SO2����2H2O Ʒ����Һ����ɫ ǿ���� 2Fe3����Fe=3Fe2�� Fe��2H��=Fe2����H2�� ![]()
��
��������
��1����ͼʾ���Ӻ�װ���Ժ������ȼ��װ�õ�����������2���������������֪����A������Ϊ������ƿ��������Fe��Ũ�����жۻ���̼����Ũ���ᷴӦ������������������3��Ũ�������ǿ�����ԣ��ڼ��ȵ�������̼��Ũ���ᷴӦ�ķ���ʽΪC��2H2SO4��Ũ��![]() CO2����2SO2����2H2O�������������Ư���ԣ����B�е�������Ʒ����Һ����ɫ���������Ϸ�����֪Ũ�������ǿ����������4������Ũ�ȼ�С��ϡ�������������û���Ӧ����������������������������������������Ӧ�����������������ӷ���ʽ�ֱ�ΪFe��2H��=Fe2����H2����2Fe3����Fe=3Fe2������5����ȡag��̼�Ͻ𣬼������Ũ���ᣬ���ȴ�A�в����ݳ�����ʱ��ֹͣ���ȣ�����Eװ�ò����أ�E����bg�������ɶ�����̼������Ϊbg�����������غ㶨�ɣ���ag��̼�Ͻ��к�̼Ԫ�ص�����Ϊ
CO2����2SO2����2H2O�������������Ư���ԣ����B�е�������Ʒ����Һ����ɫ���������Ϸ�����֪Ũ�������ǿ����������4������Ũ�ȼ�С��ϡ�������������û���Ӧ����������������������������������������Ӧ�����������������ӷ���ʽ�ֱ�ΪFe��2H��=Fe2����H2����2Fe3����Fe=3Fe2������5����ȡag��̼�Ͻ𣬼������Ũ���ᣬ���ȴ�A�в����ݳ�����ʱ��ֹͣ���ȣ�����Eװ�ò����أ�E����bg�������ɶ�����̼������Ϊbg�����������غ㶨�ɣ���ag��̼�Ͻ��к�̼Ԫ�ص�����Ϊ![]() ������������Ϊ
������������Ϊ![]() ��������������Ϊ
��������������Ϊ![]() ����6����Ϊ��̿�Ͻ��е���������ϡ���ᷴӦ����������ƿ�������ļ�������Ϊ����������������������������ͨ�������������������ѡ�ۡ�
����6����Ϊ��̿�Ͻ��е���������ϡ���ᷴӦ����������ƿ�������ļ�������Ϊ����������������������������ͨ�������������������ѡ�ۡ�
�����͡�ʵ����
��������
29
����Ŀ������һ��ͭ�ۺ����۵Ļ������Ʒ,Ϊ�ⶨ����Ʒ�����ĺ���,��ȡ5.0g����Ʒ������ƿ��,��100mLϡ�����������ǡ����ȫ��Ӧ,ʣ�����2.3g.
��1����û������������������Ϊ����?
��2���������������ʵ����ʵ���Ũ��Ϊ����?
���𰸡���1�� 54% ��2�� 3mol/L
��������
��1����ȡ5.0g����Ʒ������ƿ�У���100mLϡ�����������ǡ����ȫ��Ӧ��ʣ�����2.3g���ù���Ϊͭ����˻��������������Ϊ��5.0g-2.3g=2.7g��������������Ϊ��2.7g/5.0g��100%=54%��
��2����������ķ�Ӧ��ϵʽΪ��
2Al��������6HCl
2��27g 6mol
2.7g n
���n��0.3mol
���������Ũ����0.3mol��0.1L��3.0mol/L


 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ֲ��ϸ���а���ά��ľ����Ϊԭ�Ϻϳ���ʹҩƷĪɳ���֣�G����·�ߣ�

��֪��������૽ṹʽΪ ![]() ��������������Ӧ�Ĵ�����
��������������Ӧ�Ĵ�����
��˫ϩ�ϳɷ�Ӧ�� ��
��
�� ��
��
�ش��������⣺
��1��B�Ļ�ѧʽ__��B�й����ŵ�����_____��
��2��E��G�ķ�Ӧ����______
��3��C������������ͭ������Һ��Ӧ�Ļ�ѧ����ʽΪ________
��4��D��F�Ľṹ��ʽ�ֱ���______��________
��5��д��ͬʱ��������������E��һ��ͬ���칹��ļ�ʽ________
�ٷ����к��б��� ���ܷ���������Ӧ ������FeCl3��Һ������ɫ��Ӧ
��6���л���H��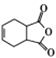 ���Ǻϳɿ�����ҩ�ﰢ����Τ���м��壮���������ϳ�·�ߣ�д����1��3������ϩΪԭ���Ʊ�H�ĺϳ�·������ͼ�����Լ����ã��� ________
���Ǻϳɿ�����ҩ�ﰢ����Τ���м��壮���������ϳ�·�ߣ�д����1��3������ϩΪԭ���Ʊ�H�ĺϳ�·������ͼ�����Լ����ã��� ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������̼�ᡢ�����ᡢ������ĵ���ƽ�ⳣ�����±�:
H2CO3 | H2SO3 | HClO |
K1=4.30��10-7 | K1=1.54��10-2 | K=2.95��10-8 |
K2=5.61��10-11 | K2=1.02��10-7 |
����˵����ȷ����
A. ��ͬ������,ͬŨ�ȵ� H2SO3��Һ�� H2CO3��Һ�����ԣ� ���߸�ǿ
B. Na2CO3��Һ��ͨ������SO2�� 2CO3 2- + SO2+ H2O = 2HCO3 - + SO3 2-
C. NaClO ��Һ��ͨ������CO2:2ClO- + CO2 + H2O = 2HClO + CO3 2-
D. ����ˮ�зֱ�����Ũ�ȵ� NaHCO3 �� NaHSO3��Һ,���������ˮ�� HClO ��Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������ʽΪC7H8�ķ����������Ĵ��������������ӳɺ����ɻ���������д���û�������һ�ȴ���Ľṹ��ʽ��______��______��_______��_______��_______��
��2������C8H18��һ��ͬ���칹��ֻ����һ��һ�ȴ����д�������칹��Ľṹ��ʽ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ���±���
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
T | M���ϵĵ�������ԭ�Ӻ�����Ӳ�����2�� |
X | �����������Ǵ�����������2�� |
Y | �����µ���Ϊ˫ԭ�ӷ��ӣ����⻯���ˮ��Һ�ʼ��� |
Z | Ԫ�����������+7�� |
����������⣺
��1��Ԫ��X��һ��ͬλ�ؿɲⶨ�������������ͬλ�صķ�����________��
��2��Ԫ��Y����Ԫ���γ�һ�ַ���YH3��д�������ӵĵ���ʽ________��
��3��Ԫ��Z��Ԫ��T��ȣ��ǽ����Խ�ǿ����________����Ԫ�ط��ű�ʾ�������б�������֤������________��
a��������Z�ĵ��ʺ�T�ĵ���״̬��ͬ
b��Z���⻯���T���⻯���ȶ�
c��һ��������Z��T�ĵ��ʶ�����NaOH��Һ��Ӧ
��4��T��X��Z����Ԫ������������ˮ����������ǿ������˳����_____���û�ѧʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:25 C ʱ,Ksp[Zn(OH)2]= 1.0��10-18�� Ka(HCOOH)= 1.0��10-4�����¶��£�����˵���������
A. HCOO����ˮ��ƽ�ⳣ��Ϊ 1.0��10-10
B. �� Zn(OH)2 ����Һ�м����� HCOOH,��Һ�� c(Zn2+)����
C. Zn(OH)2����ˮ�γɵı�����Һ��,c(Zn2��)>1.0��10-6 mol/L
D. Zn(OH)2(s) +2HCOOH(aq)![]() Zn2+(aq) +2HCOO��(aq) +2H2O(l)��ƽ�ⳣ�� K= 100
Zn2+(aq) +2HCOO��(aq) +2H2O(l)��ƽ�ⳣ�� K= 100
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����A������KAl(SO4)2��Al2O3��Fe2O3����һ�������¿�ʵ����ͼ��ʾ������֮��ı仯��

�ݴ˻ش��������⣺
��1��I��II��III��IV�IJ�������ȡ�ķ��뷽����___________________��
��2������������ͼ��Ӧ��ϵ��д������B��C��E�������ʵĻ�ѧʽ
��������B________________��C______________________��E_______________
��3��д���١����ĸ���Ӧ����ʽ�������ӷ�Ӧ��д���ӷ���ʽ��
��____________________________ ��__________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I���������а�������: ���� ������ ��SiO2 ��H2SO4 ��NaOH ��FeSO4��Һ ��Ba(OH)2 ��������������
(1)�����������ڵ���ʵ���____________(�����)���ܵ������__________ (�����)��
(2)����м���ٵķ�ĩ����Ӧ�����ӷ���ʽΪ_____________________��
(3)����������������������ˮ��Һ�з�Ӧ�����ӷ���ʽΪH++OH-=H2O����÷�Ӧ�Ļ�ѧ����ʽΪ__________________________��
(4)ʵ�����Ʊ�������ӷ���ʽΪ:__________________�����ڢ��л�������ܵ���Һ��������������________________________��
(5) ���Dz�������Ҫ�ɷ�֮һ���������Һ��Ӧ�Ļ�ѧ����ʽΪ____________________������ʦ����_______(����������)����̲�����
II�����и������ʵķ�����ᴿ��Ӧѡ��������������һ��?(��ѡ����ĸ)
A.��Һ B.���� C.��ȡ D.���� E.�����ᾧ F.���·ֽ�
(1)����CCl4��H2O:___________��
(2)��ȥ����ʯ��ˮ��������CaCO3: ___________��
(3)����CCl4(�е�Ϊ76.75��)�ͼױ�(�е�Ϊ110.6��)��Һ������:__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com