
【题目】在0.2L NaCl、MgCl2的混合溶液中,部分离子浓度大小如图所示,回答下列问题:
(1)该混合溶液中,Na+的物质的量为moL,MgCl2的物质的量为moL,Cl﹣的物质的量为moL.
(2)该混合溶液中含溶质的总质量为g.
(3)将该混合溶液加水稀释至体积为 1L,稀释后溶液中Cl﹣的物质的量浓度为 moLL﹣1 . 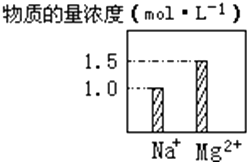
【答案】
(1)0.2;0.3;0.8
(2)40.2
(3)0.8
【解析】解:(1)溶液中c(Na+)=1mol/L,c(Mg2+)=1.5mol/L, 0.2L溶液中,n(Na+)=1mol/L×0.2L=0.2mol,n(Mg2+)=1.5mol/L×0.2L=0.3mol,
溶液中n(MgCl2)=n(Mg2+)=0.3mol,
根据电荷守恒可知:n(Cl﹣)=n(Na+)+2n(Mg2+)=0.2mol+0.3mol×2=0.8mol.
故答案为:0.2;0.3;0.8;(2)溶液中溶质为NaCl、MgCl2 , 溶质总质量=0.2mol×58.5g/mol+0.3mol×95g/mol=40.2g,
故答案为:40.2;(3)将该混合溶液加水稀释至体积为 1L,稀释后溶液中Cl﹣的物质的量浓度为 ![]() =0.8moLL﹣1 ,
=0.8moLL﹣1 ,
故答案为:0.8.
(1)根据n=cV计算n(Na+)、n(Mg2+),溶液中n(MgCl2)=n(Mg2+),根据电荷守恒可知,n(Cl﹣)=n(Na+)+2n(Mg2+);(2)溶液中溶质为NaCl、MgCl2 , 根据m=nM计算;(3)根据c= ![]() 计算.
计算.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列关于阿伏加德罗常数的说法不正确的是
A. 0.012 kg 12C含有的碳原子数就是阿伏加德罗常数
B. 含有阿伏加德罗常数个粒子的物质的量是1 mol
C. 1 mol NH3所含原子数约是2.408×1024
D. 6.02×1023就是阿伏加德罗常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f是前四周期原子序数依次增大的6种元素,a元素的基态原子核外s能级上的电子数是p能级上电子数的2倍;c元素原子的最外层电子数是次外层电子数的3倍;d是地壳中含量最高的金属元素;e的正三价基态离子的d能级为半充满结构;f的基态原子最外层只有一个电子,且内层电子排布均为全充满结构。
(1)b元素基态原子的价电子排布图为________。
(2)a、b、c三种元素的第一电离能由大到小的顺序为_________。(用元素符号回答)
(3)b与c组成的一种分子甲中有16个价电子,甲分子与______(填写一种物质的分子式)是等电子体,甲分子中σ键和π键的数目比是______。
(4)c的氢化物中,电子总数为18的分子是乙,乙中c原子的杂化方式为_______。它是______分子(填“极性”或“非极性”)
(5)已知c、f能形成两种化合物,其晶胞如图所示,甲的化学式为_________。高温时,甲易转化为乙的原因为_________。

(6)e元素对应的单质在形成晶体时,采用如图所示的堆积方式_________。则这种堆积模型的配位数为,如果e的原子半径为 r pm;阿伏伽德罗常数的值为NA,计算此单质的密度表达式为_______g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为有机物,其中A常用来衡量一个国家石油化工发展水平的标志性物质,它们之间有如图转化关系。已知醛基在氧气中易被氧化成羧基,请回答下列问题:

(1)A的官能团名称为__________。
(2)属于取代反应的有______________(填对应编号)。
(3)满足下列条件的有机物有_________种。
a.与B互为同系物 b.含有5个碳原子
(4)写出下列编号对应反应的化学方程式:
②________________________________________________________。
④_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是重要的有机化工原料。下列关于苯的性质说法正确的是( )
A. 常温常压下为气体 B. 能发生氧化反应 C. 不能发生取代反应 D. 易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物说法正确的是( )
A.蛋白质水解的最终产物是多肽
B.麦芽糖及其水解产物均能发生银镜反应
C.油脂都不能使溴的四氯化碳溶液褪色
D.淀粉、纤维素完全水解的产物互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
①钠在空气中燃烧生成白色的氧化钠
②钠投入硫酸铜溶液中有红色粉末产生
③过氧化钠可在防毒面具中做供氧剂
④铁丝在氯气中燃烧生成红棕色的
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.2017年08月08日21时19分46秒在四川阿坝州九寨沟县发生7级地震。地震后,为防止疫病流行,全国各地向灾区运送了大量的消毒剂、漂白剂等。请回答下列相关问题:
(1)次氯酸盐是一些漂白剂和消毒剂的有效成分。84消毒液的有效成分是次氯酸钠,制取该消毒液的化学方程式为_______。
(2)二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在一定条件下与SO2反应制得。该反应的离子方程式为:_______。
(3)漂白剂亚氯酸钠(NaClO2)在常温黑暗处可保存一年,但亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。
当1 molHClO2发生分解反应时,转移电子的物质的量是_________mo1。
Ⅱ.溴及其化合物广泛应用在有机合成、化学分析等领域。
(4)海水提溴过程中溴元素的变化如下:
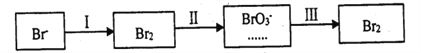
①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。调海水PH可提高Cl2的利用率.用平衡原理解释其原因是______________。
②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列方程式。
_____Br2+_______Na2CO3 =______NaBrO3+_____CO2+____。
(5)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
粒子 | I2 | Br2 | IO3- |
物质的量/mol | 0.5 | 1.3 |
则原溶液中NaI的物质的量是_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com