
����Ŀ����֪��pKa����lgKa��25��ʱ��H2A��pKal��1.85��pKa2��7.19�������£���0.1 mol��L-1NaOH��Һ�ζ�20 mL 0.1 mol��L-1H2A��Һ�ĵζ�������ͼ��ʾ������˵����ȷ����

A. a��������Һ�У�V0��10 mL
B. b��������Һ�У�c(H2A)+c(H+)��c(HA��)+c(OH��)
C. A2��ˮ��ƽ�ⳣ��Kh(A2��)��10��7.19
D. c��������Һ�У�c(A2��)��c(HA��)
���𰸡�D
��������A������ͼ���֪��a��pH=1.85=pKal����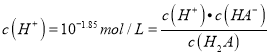 ������a��c(H2A)=c(HA-)������A������a������NaOHΪ10mL����a����Һ������ΪH2A��NaHA�������ʵ���֮��Ϊ1��1������Ҫ���ǵ����ˮ�⣬��pKal��1.85��pKa2��7.19��֪��H2A��NaHA��1��1���ʱ��H2Aռ��Ҫ��λ�����Դ�ʱ��Һ��c(H2A)��c(HA-)�����費������ʵ����a��NaOHӦ��С��10mL����A���� B��b������0.1molL-1NaOH��Һ�ζ�20mL0.1molL-1H2A��Һ��ǡ�÷�Ӧ����NaHA���������غ�ɵ�c(H2A)+c(H+)=c(A2-)+c(OH-)����B���� C��A2-ˮ��ƽ�ⳣ��Khl=Kw/Ka2=10-6.81����C����D��c��pH=7.19=pKa2��
������a��c(H2A)=c(HA-)������A������a������NaOHΪ10mL����a����Һ������ΪH2A��NaHA�������ʵ���֮��Ϊ1��1������Ҫ���ǵ����ˮ�⣬��pKal��1.85��pKa2��7.19��֪��H2A��NaHA��1��1���ʱ��H2Aռ��Ҫ��λ�����Դ�ʱ��Һ��c(H2A)��c(HA-)�����費������ʵ����a��NaOHӦ��С��10mL����A���� B��b������0.1molL-1NaOH��Һ�ζ�20mL0.1molL-1H2A��Һ��ǡ�÷�Ӧ����NaHA���������غ�ɵ�c(H2A)+c(H+)=c(A2-)+c(OH-)����B���� C��A2-ˮ��ƽ�ⳣ��Khl=Kw/Ka2=10-6.81����C����D��c��pH=7.19=pKa2�� 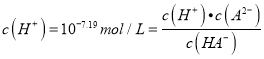 ������c(A2-)=c(HA-)����D��ȷ��ѡD��
������c(A2-)=c(HA-)����D��ȷ��ѡD��


 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��113��Ԫ�ص�Ԫ�ط���ΪNh����������Ϊ����������һ���˹��ϳɵķ����Ի�ѧԪ�أ������йظ�Ԫ�ص�˵���д������
A.λ�ڵ������ڵڢ�A��
B.��ѧ��Ӧ�е���Nh����������
C.��ͬ��������ϡ���ᷴӦʱNh��A1����
D.���������ΪNh2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ����500mL0.2mol/L����������Һ��ʵ�鲽������У�
��1������д����հ״���
A������ƽ�ϳƳ� g�����ƹ��壬���������ձ��������������ˮ�ܽ⣮
B���ѵõ�����ҺС�ĵ����Ų�����ע�� mL������ƿ�У�
C������������ˮϴ���ձ��Ͳ�����2��3�Σ�ÿ��ϴ��ҺҲС��ת������ƿ�У�
D������������ƿ�м�����ˮ��Һ���̶�1��2cm�������� С�ĵμ�����ˮ����Һ��Һ��ײ���̶���ˮƽ���У�
E����ƿ�����������ҡ�ȣ�
F������õ���Һ�����Լ�ƿ�У����ϱ�ǩ����ϴ������ƿ��
��2�����������ʹ������ҺŨ��ƫ�ߵ��� ������ţ���
������ƿ��ǰ�ڱ�մ��ˮ�� ��û�н��������IJ�������C
��δ��ȴ�����¾�ע������ƿ���� �ܶ���ʱ��ˮ�Ӷ��ˣ��õι�����
�ݶ���ʱ����������ƿ�̶��� ����ʱ����������ƿ�̶���
��3�����ʵ������98%��Ũ���ᣨ�ܶ�Ϊ1.8gcm��3�� ���� 3.6molL��1��ϡ����150mL����������Ũ��������Ϊ mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ��̶�Ϊ2L���ܱ������г���9.6molNO��4.8molO2���������·�Ӧ����2NO(g)+O2(g) ![]() 2NO2(g)��H<0 ��2NO2(g)=N2O4(g) ���NO2��N2O4��Ũ�ȱ仯��ͼ��ʾ��0��10minά�������¶�ΪT����10minʱ�ı�ij��Ӧ������һ��ʱ����ٴ�ƽ�⡣����˵����ȷ����
2NO2(g)��H<0 ��2NO2(g)=N2O4(g) ���NO2��N2O4��Ũ�ȱ仯��ͼ��ʾ��0��10minά�������¶�ΪT����10minʱ�ı�ij��Ӧ������һ��ʱ����ٴ�ƽ�⡣����˵����ȷ����

A. ǰ5min��Ӧ��ƽ������v(NO)=0.24mol��(L��min)��1
B. T��ʱ��Ӧ�ٵĻ�ѧƽ�ⳣ��K=0.36
C. 10minʱ�ı䷴Ӧ���������ǽ����¶�
D. ����ʼʱ��������г���1.6mol NO2��4.0mol N2O4��T��ﵽƽ��ʱ��NO2�����ʵ���Ũ����ͼ��5��10min�IJ�ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г����ʵķ��������е��ǣ� ��
A.�ù�����ˮ��ȥAl3����Һ�е�����Fe3��
B.���������ͨ�����ȵ�ͭ����N2�е�����O2
C.�����Ƶ���ʯ�ң�ͨ�����������Գ�ȥ�Ҵ��е�����ˮ
D.�������ȥAgCl��������Ag2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ��һ��ʳ�����ϣ��ṹ��ʽ��ͼ���й�����ϩ�ķ�����ȷ���ǣ� �� ![]()
A.����ϩ��һ�ȴ�����8��
B.����ϩ�� ![]() ��Ϊͬ���칹��
��Ϊͬ���칹��
C.����ϩ�ķ��������е�̼ԭ�ӿ�����ͬһ��ƽ����
D.һ�������£�����ϩ���Է����ӳɡ�ȡ�����������Ӿۡ������ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼������Ҫ�ķǽ���Ԫ�أ�����Ӧ�úʹ���̼�͵��Ļ��������������������Ҫ���塣
I.�о�������Ⱦ��������ǻ�����һ����Ҫ������
T��ʱ���������·�Ӧ��3NO(g)+O3(g)![]() 3NO2(g)����0.6molNO��0.2molO3������뵽2L�̶��ݻ��ĺ����ܱ������У�NO��Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ��
3NO2(g)����0.6molNO��0.2molO3������뵽2L�̶��ݻ��ĺ����ܱ������У�NO��Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ��
��T��ʱ����Ӧ3NO(g)+O3(g)![]() 3NO2(g)��ƽ�ⳣ��K=_____��
3NO2(g)��ƽ�ⳣ��K=_____��
�ڲ���˵����Ӧ�ﵽƽ��״̬����______________��
A��������ɫ���ٸı� B�������ƽ��Ħ���������ٸı�
C��������ܶȲ��ٸı� D����λʱ��������O3��NO2���ʵ���֮��Ϊ1��3

II��NO2�Ķ�����N2O4�ǻ���г���������������������⡣��ͼ2��ʾ��A���ɵ��Ȳ����Ƴɵ��ܱ�������B��һ�ͻ�ѧ��ʴ�����ڴ��ȵ������ң��ر�K2������1molNO2ͨ��K1��K3�ֱ�������A��B�У���Ӧ��ʼʱA��B�������ͬ��ΪaL�����Ե����е������������
��������A�е���ƽ������ʱ��ts���ﵽƽ���������ѹǿΪ��ʼѹǿ��0.8������ƽ����ѧ��Ӧ����v��NO2��=_______��
������K2��ƽ���B�������������0.4aL�����K2֮ǰ������B���Ϊ__________L��
����ƽ�����A�������ٳ���0.5molN2O4�������µ���ƽ���ƽ��������NO2���������____���������������С����������������
��.���в�ͬ��̬���������NO��N2O3��NO2�ȣ�������һ�������¿����ת����
��1��ij�¶��£���һ����ɱ���ܱ������г���1mol N2O3��������ӦN2O3![]() NO2(g)+NO(g)���ﵽƽ�����t1ʱ�̸ı�ijһ������������ʱ��ı仯ͼ����ͼ��ʾ���й�˵����ȷ����__________
NO2(g)+NO(g)���ﵽƽ�����t1ʱ�̸ı�ijһ������������ʱ��ı仯ͼ����ͼ��ʾ���й�˵����ȷ����__________

A.t1ʱ�̸ı������������N2O3��Ũ�ȣ�ͬʱ��СNO2��NO��Ũ��
B.t1ʱ�̸ı�������ƽ��������Ӧ�����ƶ���N2O3��ת��������
C.��t2ʱ�̴ﵽ�µ�ƽ���NO2�İٷֺ�������
D.��t1ʱ�̽������������С��ԭ�ݻ���һ�룬������~ʱ��ͼ������ͼ��ͬ
��2����1000K�£���ij���������з������з�Ӧ��2NO2(g)![]() 2NO(g)+O2(g)����һ������NO2��������ܱ������У������ƽ��ת������(NO2)���¶ȱ仯��ͼ��ʾ��ͼ��a���Ӧ�¶���.��֪NO2����ʼѹǿP0Ϊ120kPa����ʽ������¶��·�Ӧ��ƽ�ⳣ��Kp= __________����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
2NO(g)+O2(g)����һ������NO2��������ܱ������У������ƽ��ת������(NO2)���¶ȱ仯��ͼ��ʾ��ͼ��a���Ӧ�¶���.��֪NO2����ʼѹǿP0Ϊ120kPa����ʽ������¶��·�Ӧ��ƽ�ⳣ��Kp= __________����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������


��3�����ڷ�ӦN2O4(g)![]() 2NO2(g)����һ��������N2O4��NO2����������������ѹǿ����ڹ�ϵ��v(N2O4)=k1��p(N2O4)��v(NO2)=k2��p2(NO2)�����У�k1��2���뷴Ӧ���¶��йصij�������Ӧ������-ѹǿ��ϵ��ͼ��ʾ��һ���¶��£�k1��k2��ƽ�ⳣ��Kp��Ĺ�ϵ��k1=____________������ͼ������У�ָ���ܱ�ʾ��Ӧ�ﵽƽ��״̬��������__________��������__________________________��
2NO2(g)����һ��������N2O4��NO2����������������ѹǿ����ڹ�ϵ��v(N2O4)=k1��p(N2O4)��v(NO2)=k2��p2(NO2)�����У�k1��2���뷴Ӧ���¶��йصij�������Ӧ������-ѹǿ��ϵ��ͼ��ʾ��һ���¶��£�k1��k2��ƽ�ⳣ��Kp��Ĺ�ϵ��k1=____________������ͼ������У�ָ���ܱ�ʾ��Ӧ�ﵽƽ��״̬��������__________��������__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:�ټ�ȩ(HCHO)�������ǻ�ѧ�������ƣ������л�ԭ�ԡ��ڼ����������ˮ��Ϊ̽��������ȩ������Cu(OH)2��Ӧ�IJ����������ʵ�顣
��1������ͼװ���н���ʵ�飬��a�м���0.5 mol��L-1CuSO4��Һ50 mL��5 mol��L-1NaOH��Һ100 mL�����ټ���40���ļ�ȩ��Һ50 mL����������20���Ӻ���ȴ�����¡�

������a��������_____________��
����˵����ȩ���л�ԭ�Ե�ʵ��������______________��
��2������ʵ���и���Ӧ����������������ΪCO��H2�е�һ�ֻ����֡�Ϊȷ������ɷ֣���װ��A������ͼ��ʾװ�����Ӻ����ʵ�顣

�������ӵĺ���˳��ΪA��B��___��____��____��____��G��װ��B��������_________����H2��ʵ��������_________________________��
��3����֪HCHO![]() HCOOH
HCOOH![]() H2CO3�����ʵ��֤��a�м�ȩ�е�̼Ԫ��δ��������+4�ۡ�д��ʵ�������������______________________��
H2CO3�����ʵ��֤��a�м�ȩ�е�̼Ԫ��δ��������+4�ۡ�д��ʵ�������������______________________��
��4����Ӧ��a���к�ɫ���������Ϊ̽������ɣ�������¼��裺
����һ��ֻ��Cu2O�� �������ֻ��Cu��
��������Cu2O��CuO �����ģ�________________________ ��
����_______���Բ�������������___________________________ ��
��������ʵ�飨����ÿ������ַ�Ӧ����

��֪��Cu2O ![]() [Cu(NH3)4]+����ɫ��
[Cu(NH3)4]+����ɫ��![]() [Cu(NH3)4]2+����ɫ��
[Cu(NH3)4]2+����ɫ��
����ƿii�й�����ȫ�ܽ������ɫ��Һ�����ӷ���ʽΪ____________________��
�ڽ�����ƿii�е���Һϡ��100������Һ����ɫ������ƿi������ɴ˿�֪����������ɼ����ʵ���֮��ԼΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ҹ���ѧ�ҷ������ɳ����-������̼��ء�������ͼ�����ŵ�ʱ����ܷ�ӦΪ��4Na+3CO2=2Na2CO3+C������˵����ȷ����( )

A. ���ʱ���Ʋ�����ӵ�Դ����������
B. ��ع����¶ȿ�����200������
C. ���ʱ��Na+�������ƶ�
D. �ŵ�ʱ�������ĵ缫��ӦΪ��4Na++3CO2+4e-=2Na2CO3+C
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com