
����Ŀ��һ�������£���2L�����ܱ������г���1molCOCl2(g)������Ӧ��COCl2(g)![]() Cl2(g)+CO(g)����Ӧ�����в�õ��й��������±���
Cl2(g)+CO(g)����Ӧ�����в�õ��й��������±���
t/s | 0 | 2 | 4 | 6 | 8 |
N(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
����˵������ȷ����
A. ʹ�ô����ܹ��ı䷴Ӧ����
B. �ﵽ6sʱ����Ӧֹͣ�����ٽ���
C. ��8sʱ����Ӧ�����и����ʵ�Ũ�Ȳ��ٷ����仯
D. ����Cl2��ƽ����Ӧ���ʣ�0~2s��ƽ�����ʱ�2~4s��
 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3��CO2��������Ҫ�Ļ���ԭ�ϣ�
��1����һ���¶��£��ڹ̶�������ܱ������з�����Ӧ��N2+3H22NH3 �� �ÿ��淴Ӧ�ﵽ��ѧƽ��ı�־��������ĸ����a.3v��H2����=2v��NH3����
b����λʱ������mmolN2��ͬʱ����3mmolH2
c�����������ܶȲ�����ʱ��仯
d��amol ![]() �����ѵ�ͬʱ����6amolN��H������
�����ѵ�ͬʱ����6amolN��H������
��2��CO2��NH3�����ںϳ����أ�ԭ���������������ٺϳɰ�������泥�CO2��g��+2NH3��g��=H2NCOONH4��s������H=��159.47kJ/mol
�ڰ�������立ֽ⣺H2NCOONH4��s��=CO��NH2��2��s��+H2O��l��
��H=+28.49kJ/mol����2molCO2��ȫ��Ӧ�ϳ����صġ�H= ��
��3�������ѧ�������Ƴɹ�һ�����ʹ������ܽ�CO2ת��Ϊ���飮�ڳ�ѹ��300�棬CO2��H2�����Ϊ1��4ʱ��Ӧ��CO2ת���ʴ�90%��
�ٴ˷�Ӧ�Ļ�ѧ����ʽ����
��һ�������£�ij��ȤС�飬�����ΪVL���ܱ������У�ģ��˷�Ӧ�ﵽ��ѧƽ��״̬���÷�Ӧ��ƽ�ⳣ������ʽΪ����ͼ��֪�����¶ȣ�K�������������С�����䡱����300��ʱ���ӷ�Ӧ��ʼ�����ﵽƽ�⣬��H2��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ����������nA��tA��V��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4mol SO2��2molO2����4L���ܱ������У���һ�������·�Ӧ�ﵽƽ�⣺2SO2+O22SO3���ƽ��ʱ������ܵ����ʵ���Ϊ5mol����
��1��ƽ��ʱ�����ʵ�Ũ�ȣ�
��2��ƽ��ʱSO2��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Ga)��������ͬ����Ԫ�أ�������������Ϊ����������������������������Ϊ���Ի������ҵ�Ʊ������ص���������ͼ��ʾ��
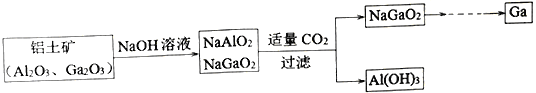
�����жϲ���������
A. ��Ϊ+3�� B. ���ԣ�Ga(OH)3>Al(OH)3
C. Ga2O3����ǿ�ᡢǿ�Ӧ D. NaGaO2��CO2��Ӧ��˵���صĽ�����ǿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���CO2��������ȡ���ͷ���ȡ��ͻ���Խ�չ��CO2ת������ʾ��ͼ���£�

�ش��������⣺
��1��������̼�����еĻ�ѧ����_________________�������ҵĻ�ѧʽ��______________��
��2��д����Ӧ�ٵĻ�ѧ����ʽ__________________________________��
��3��ʵ���ҳ��ô���̼�����ϡ���ᷴӦ��ȡ������̼���壬��Ӧ�����в���������̼������V(CO2) ��ʱ���ϵ����ͼ��

����ͼ���������ѧ��Ӧ�������һ����___________��
��Ϊ������������ѧ��Ӧ�ķ�Ӧ���ʣ�������Һ�м����������ʣ�����Ϊ���е���_________(��д���)��
A.����ˮ B.�Ȼ�����Һ C.Ũ���� D.����
��4��������̼��������������Һ��Ӧ�����������ƹ���ʱ��Ӧ����̼���ƣ���������������ʱ��Ӧ����̼�����ơ���������̼���������Ʒ��ɵ����ʵ�����Ϊ2:3ʱ����Һ�е�������_______________��
��5����ԭ�ӽṹ�Ƕ�˵����ԭ�ӵõ�������ǿ��̼ԭ�ӣ�___________________________________��
��6����һ�������£���ҵ��Ҳ����CO2�ϳɼ״�(CH3OH)���仯ѧ����ʽΪ��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)�� ��a molCO2��bmolH2�����ݻ�Ϊ2L���ܱ������з���������Ӧ��t minʱ��ü״������ʵ���Ϊc mol������0-t min��CO2�ķ�Ӧ����Ϊ_________ mol��L-1��s-1�� [X �ķ�Ӧ���ʦ�(X)=X�����ʵ���Ũ�ȱ仯/�仯��Ҫ��ʱ��]
CH3OH(g)+H2O(g)�� ��a molCO2��bmolH2�����ݻ�Ϊ2L���ܱ������з���������Ӧ��t minʱ��ü״������ʵ���Ϊc mol������0-t min��CO2�ķ�Ӧ����Ϊ_________ mol��L-1��s-1�� [X �ķ�Ӧ���ʦ�(X)=X�����ʵ���Ũ�ȱ仯/�仯��Ҫ��ʱ��]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ���ܱ�������X��Y��Z�����������ʼŨ�Ⱥ�ƽ��Ũ�����������˵��������ǣ� ��
���� | X | Y | Z |
��ʼŨ��/molL��1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/molL��1 | 0.05 | 0.05 | 0.1 |
A.��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50%
B.��Ӧ�ɱ�ʾΪX+3Y2Z��ƽ�ⳣ��Ϊ1600
C.������������ʱ������ѹǿ��ʹƽ�ⳣ������
D.�ı��¶ȿ��Ըı�÷�Ӧ��ƽ�ⳣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ(ʡ�Լгֺ;���װ��)�����ô�װ�úͱ����ṩ������������ʵ�飬�������ѡ����(����)

ѡ�� | a�е����� | b�е����� | c���ռ������� | d�е����� |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | Ũ���� | Na2SO3 | SO2 | NaOH��Һ |
C | ϡ���� | п�� | H2 | NaOH��Һ |
D | Ũ���� | MnO2 | Cl2 | NaOH��Һ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�����ʵ�ķ�Ӧ����ʽ��ȷ���ǣ� ��
A.��������ˮ��Һ�Լ��ԣ�SO32��+2H2O?H2SO3+2OH��
B.SO2��ˮ��Һ�����ԣ�SO2+H2O?H2SO3?2H++SO32��
C.ȼúʱ����ʯ��ʯ����SO2�ŷţ�2CaCO3+2SO2+O2 ![]() 2CaSO4+2CO2
2CaSO4+2CO2
D.ŨNaOH��Һ����������������SO2+OH���THSO3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com