
����Ŀ��ijС��������ͼ��ʾװ���Ʊ�����NCl3����֪��NCl3����Cl2��NH4Cl��Һ�������¶��·�Ӧ���ɡ������£�NCl3Ϊ��ɫ��״Һ�壬�۵�Ϊ-40�棬�е�Ϊ71�棻���ױ�ը����Ȼ��ը��Ϊ95�档
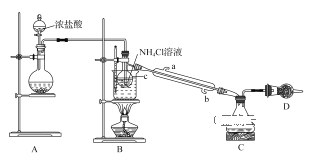
�ش��������⣺
��1��װ��A��Բ����ƿ����ʢ�ŵĹ�����___���ѧʽ����
��2��װ��B������C��������___��ʵ������и������ڷ�����Ӧ�Ļ�ѧ����ʽΪ___��
��3��װ��B���ձ���Ӧ����ˮԡ���ȵ��¶ȷ�ΧΪ____��
��4��װ��D����ʢ�ŵ��Լ�����Ϊ����ѡ���е�___������ĸ����
a����ʯ�� b��NaOH���� C����ʯ�� d����ˮCaCl2
��5���������Ͽ�֪�����pH<5��NH4Cl��ҺҲ���Ƶ�NCl3��������в���NCl3�ĵ缫Ϊ___��������������������������õ缫�ĵ缫��ӦʽΪ___��
���𰸡�KMnO4��KClO3��Ca(ClO)2�� ������ƿ NH4Cl+3Cl2=NCl3+4HCl 71��95�� d ���� 3Cl-+NH4+-6e-=NCl3+4H+
��������
��1��װ��A��������ȡ������װ�ã��÷�Ӧ����Ҫ���ȣ��ʲ���ʹ�ö������̣�������ȡ�����ķ���ΪŨ�����������ػ�������ػ���������εȲ���Ҫ���ȶ�������ȡ������
����KMnO4��KClO3��Ca(ClO)2��
��2��װ��B������C��������������ƿ��ʵ������и������ڷ�����ӦΪ�������Ȼ����ˮԡ���ȵ������·���������ԭ��Ӧ��ȡ���Ȼ�������ѧ����ʽΪNH4Cl+3Cl2=NCl3+4HCl��
��Ϊ��������ƿ��NH4Cl+3Cl2=NCl3+4HCl��
��3������Ŀ��Ϣ�������£�NCl3Ϊ��ɫ��״Һ�壬�۵�Ϊ-40�����е�Ϊ71�������ױ�ը����Ȼ��ը��Ϊ95����Ҫ�ռ�NCl3�¶Ȳ��õ���71������ֹ��ը��Ȼ���¶Ȳ��ó���95����
����71��95����
��4��װ��DΪβ������װ�ã�װ������δ���뷴Ӧ���������ж������ڴ�����Ⱦ���Ҫ���մ�������ˮ�Ȼ����������Ը�������������ն���δ��Ӧ���������������ڸ�ʵ���β��������
��ѡd��
��5���������Ͽ�֪�����pH<5��NH4Cl��ҺҲ���Ƶ�NCl3�����ݻ��ϼ۱仯��N��3�۱�Ϊ+3�ۣ�ʧȥ���ӣ��ڵ�����ӦΪ������Ӧ��������в���NCl3�ĵ缫Ϊ�����������ĵ缫��ӦʽΪ��3Cl-+NH4+-6e-=NCl3+4H+��
�ʴ�Ϊ�������� 3Cl-+NH4+-6e-=NCl3+4H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���ƴ����ȼ���������ҵ�ĸ�����CCl4���Լ�����Գ�������ƻ�����ѧ���о��ڴ��������£�ͨ�����з�Ӧ��CCl4��H2 ![]() CHCl3��HClʹCCl4ת��Ϊ��Ҫ�Ļ���ԭ���ȷ�(CHCl3)���˷�Ӧ�����и���Ӧ��������CH2Cl2��CH3Cl��CH4 �ȡ���֪CCl4�ķе�Ϊ77 �棬CHCl3�ķе�Ϊ61.2 �档
CHCl3��HClʹCCl4ת��Ϊ��Ҫ�Ļ���ԭ���ȷ�(CHCl3)���˷�Ӧ�����и���Ӧ��������CH2Cl2��CH3Cl��CH4 �ȡ���֪CCl4�ķе�Ϊ77 �棬CHCl3�ķе�Ϊ61.2 �档
(1)���ܱ������У��÷�Ӧ�ﵽƽ��״̬�����������(���費���Ǹ���Ӧ)��
ʵ�� ��� | �¶�/�� | ��ʼCCl4��Ũ�� (mol��L��1) | ��ʼH2��Ũ�� (mol��L��1) | CCl4��ƽ��ת���� |
1 | 110 | 0.8 | 1.2 | A |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | B |
�ٴ˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ_____________��
��ʵ��1�У�CCl4��ת����A________50%(������������С��������������)��
��ʵ��2�У�10 h��ﵽƽ�⣬H2��ƽ����Ӧ����Ϊ________________��
��ʵ��3�У�B��ֵ________(�����)��
A ����50% B ����50% C С��50% D �ӱ����������ж�
(2)120 ��ʱ������ͬ�������ܱ������У��ֱ����H2 �ij�ʼŨ��Ϊ2 mol��L��1��4 mol��L��1��ʵ�飬��÷�Ӧ����CCl4�İٷ���(x%)����������CHCl3�İٷֺ���(y%)��ʱ��(t)�ı仯��ϵ��ͼ(ͼ��ʵ��������CCl4�İٷ��ʱ仯���ߣ������Dz�����CHCl3�İٷֺ����仯����)��

����ͼ�е��������У���ʾH2����ʼŨ��Ϊ2 mol��L��1��ʵ������CCl4�İٷ��ʱ仯���ߵ���________(�����)��
�ڸ�����ͼ���ߣ���������ʼŨ��Ϊ________ mol��L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe2(SO4)3��Һ�����ڸ�ʴ��Ե���ϵ�ͭ��������ӡˢ��·�塣�������һ���������£��Ӹ�ʴ��ķ�Һ(��Ҫ��Fe3+��Fe2+��Cu2+)�л���ͭ�������»��Fe2(SO4)3��Һ��
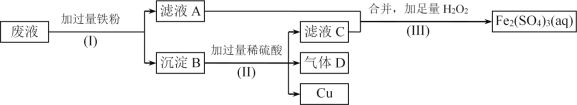
(1)����(I)�з����������Ϊ____________________��
(2)����B����Ҫ�ɷ���____________________������D�ĵ���ʽΪ__________��
(3)д������(III)�з�����Ӧ�����ӷ���ʽ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�Ksp[Pd(OH)2]=1.0��10-30�������ʵ���Ũ����ͬ��NaOH��Na2S�Ļ����Һ�еμ�Pd(NO3)2��Һ����Pd(OH)2��PdS���ֳ�������Һ�������ӡ�������Ũ�ȹ�ϵ��ͼ��ʾ��ͼ�е�p(Pd)=-lgc(Pd2+)��p(B)=-lgc(OH-)��-lgc(S2-)������˵��������ǣ� ��

A. ���ߢ��ʾ����Pd2+��OH-Ũ�ȹ�ϵ������
B. ���¶��£�Ksp(PdS)=1.0��10 -58
C. �����¶�ʱ��b����ܻ���c���ƶ�
D. ���¶��£���d���Ӧ����Һ�м����Ӧ�����ӵ����Σ�d����b���ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ʯ����ֻ�������������SiO2��ȡ36g���ڹ�����ϡ�����У����ˡ�ϴ�ӡ�������5.6g�������õ�����Һ�м���������NaOH��Һ�����ˡ�ϴ�Ӻ������գ���32g����ɫ���壮�����������н��۲���ȷ���ǣ�������
A. ������ʯת��Ϊ����ɫ����Ĺ����з�����������ԭ��Ӧ
B. ���������õ�����Һ��n��Fe2+����n��Fe3+��=1��1
C. ����ʯ�е�����������Ļ�ѧʽһ����Fe3O4
D. ��ϡ����Ϊ3.0molL��1 400mL����Ӧǰ������仯���Բ��ƣ�����Һ��ʣ��H+�����ʵ���Ũ����0.5molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ�� �����ֳ�aһૼ�ȩ����һ���Ʊ�����ҩ��ͻ�����Ʒ��ԭ�ϡ�һ�������Ʊ�����-66�ĺϳ�·����ͼ��
�����ֳ�aһૼ�ȩ����һ���Ʊ�����ҩ��ͻ�����Ʒ��ԭ�ϡ�һ�������Ʊ�����-66�ĺϳ�·����ͼ��
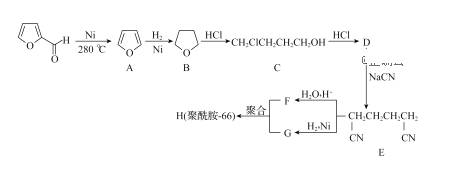
��֪����1��R-CN![]() R-COOH R-CN
R-COOH R-CN![]() R-CH2NH2
R-CH2NH2
��2��RCHO+CH3CHO![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
�ش��������⣺
��1��C�к��еĹ���������Ϊ______��
��2���л���D�Ļ�ѧ����Ϊ________��
��3����D����E�ķ�Ӧ����Ϊ_______��
��4��д��F��G��Ӧ����H�Ļ�ѧ����ʽ��______��
��5����ȩ�������IJ���ΪC5H10O2�����以Ϊͬ���칹�������������л��ﹲ��_____�֡�
��6���Կ�ȩ���Ҵ�Ϊԭ�ϣ������Լ���ѡ��������Ʊ�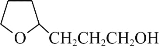 �ĺϳ�·�ߡ�______
�ĺϳ�·�ߡ�______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����������(��Ҫ�ɷ�ΪAl2O3����Fe2O3����)Ϊԭ��ұ�����Ĺ����������£�
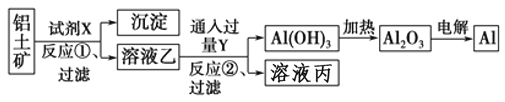
����������ȷ����
A. ���������̣��Լ�X����������������Һ��Ҳ����������
B. ��Ӧ�ٹ��˺����ó���Ϊ������
C. ͼ�����е�ת����Ӧ������������ԭ��Ӧ
D. ��Ӧ�ڵ����ӷ���ʽΪ2AlO2����CO2��3H2O��2Al(OH)3����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�ǰ�߸պ��Ǻ����������� (����)
A. 2 mol H2O��Ħ��������1 mol H2O��Ħ������
B. 200 mL 1 mol��L-1�Ȼ�����Һ��c(Cl-)��100 mL 2 mol��L-1�Ȼ�����Һ��c(Cl-)
C. 64 g������������ԭ�����ͱ�״����22.4 Lһ����̼����ԭ����
D. 20% NaOH��Һ��NaOH�����ʵ���Ũ�Ⱥ�10% NaOH��Һ��NaOH�����ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����120 ��ʱ����a L��ϩ��b L���顢c L��Ȳ(b>c)��d L����(����)���(a+b+c+d=25)����ȼʹ֮���ȼ�պָ���ԭ�����¶ȣ�������������������
A. 10 L B. 15 L C. 25 L D. 27 L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com