
【题目】人体含氧65%、碳18%、氢10%、氮3%、钙1.5%、磷1%、钾0.35%、硫0.25%、钠0.15%、氯0.15%、镁0.05%,它们被称为人体常量元素。
(1)人体的构成元素,从周期表来看,元素数目最多族为___________ 族。属于第三周期的非金属元素的原子半径由大到小的顺序______________。人体还有许多微量元素,请列举其中的一种____________。
(2)含量最高的元素原子核外运动状态有___________种,最外层电子轨道表示式_____________;与它同族的另一种元素的活动性相比_______>_______。(用元素符号表示),请用一个事实说明该结论______。
(3)含量前3位的元素按原子个数比1:1:2形成的物质的名称是_____________(写出一种即可)。
【答案】IA p>S>Cl 碘(人体必需微量元素,也有多种包括碘、锌、硒、铜、钼、铬、钴及铁,写出其中的一种即可) 8 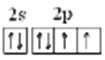 O S 2H2S + O2= 2H2O +2S 乙酸 (其它合理均给分)
O S 2H2S + O2= 2H2O +2S 乙酸 (其它合理均给分)
【解析】
(1)元素数目最多的是H元素;根据元素周期表的结构和元素周期律分析;
(2)含量最高的元素是氧元素;
(3)含量前3位的元素为O、C、H。
(1)根据人体中元素的含量可知O:0.65/10、C:0.18/12、H:0.1/1,所以人体的构成元素中元素数目最多的为氢元素,氢元素位于第ⅠA族。属于第三周期的非金属元素有P、S、Cl,同周期自左向右原子半径逐渐减小,则原子半径由大到小的顺序为p>S>Cl。人体还有许多微量元素,例如碘、锌、硒、铜、钼、铬、钴及铁等。
(2)含量最高的元素是氧元素,氧元素的核外电子数是8个,则原子核外运动状态有8种,最外层电子轨道表示式为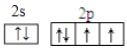 ;同主族元素从上到下非金属性逐渐减弱,则非金属性O>S,元素的非金属性越强,对应单质的氧化性越强,根据反应2H2S+O2=2H2O+2S可以说明氧元素非金属性强于硫元素。
;同主族元素从上到下非金属性逐渐减弱,则非金属性O>S,元素的非金属性越强,对应单质的氧化性越强,根据反应2H2S+O2=2H2O+2S可以说明氧元素非金属性强于硫元素。
(3)含量前3位的元素为O、C、H,它们按原子个数比1:1:2形成的物质有乙酸等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】欲配制500mL 0.2mol/L的Na2CO3溶液,回答下列问题:
(1)通过计算可知,应用托盘天平称取___________g Na2CO3。
(2)除用到天平外,还一定会用到的玻璃仪器有烧杯、玻璃棒、_____________、_______________
(3)下列操作使所配溶液浓度偏大的是_____________(填写序号)。
A.称取28.6g Na2CO3·10H2O进行配制
B.称量时用了生锈的砝码
C.往容量瓶转移溶液时,有少量液体溅出
D.Na2CO3中含有不溶性杂质
E.未洗涤溶解Na2CO3的烧杯
F.定容时俯视刻度线
G.容量瓶未干燥即用来配制溶液
H.砝码与药品位置放反了且用了游码
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《 Journal of Energy Chemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是

A. a为负极
B. 熔盐可用KOH溶液代替
C. d极电极反应式为CO32-+4e-===C+3O2-
D. 转移lmol电子可捕获CO211.2L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是潜在的碳资源,无论是天然的二氧化碳气藏,还是各种炉气、尾气、副产气,进行分离回收和提浓,合理利用,意义重大。
(1)在空间站中常利用CO2(g)+2H2(g)![]() C(s)+2H2O(g),再电解水实现O2的循环利用,350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。
C(s)+2H2O(g),再电解水实现O2的循环利用,350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。
①若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强(p)随时间(t)的变化如图中a所示,则上述反应的△H___________0(填“>”或“<”);其他条件相同时,若仅改变某一条件,测得其压强(p)随时间(t)的变化如图中曲线b所示,则改变的条件是___________。
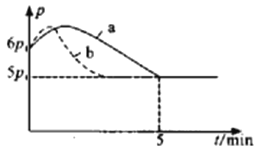
②图是反应平衡常数的对数与温度的变化关系图,m的值为___________。

(2)CO2在 Cu-ZnO催化下,同时发生如下反应I,II,是解决温室效应和能源短缺的重要手段。
Ⅰ.CO2(g)+3H2(g)![]() CH3OH (g)+H2O(g) △H1<0
CH3OH (g)+H2O(g) △H1<0
Ⅱ.CO2(g)+H2(g)![]() CO(g)+ H2O(g) △H2>0
CO(g)+ H2O(g) △H2>0
保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量及总压强如下表:

若反应I、II均达平衡时,p0=1.4p,则表中n=__________;反应1的平衡常数Kp=____ (kPa)-2。(用含p的式子表示)
(3)Al-CO2电池是一种以低温熔融盐[Al2(CO3)3]为电解质,以完全非碳的钯Pd包覆纳米多孔金属为催化剂正极的可充电电池。正极反应为:3CO2+4e-=2CO32-+C,则生成Al的反应发生在___________极(填“阳”或“阴”),该电池充电时反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氨肥样品可能含有NH4HCO3、NH4Cl、.NH4NO3中的一种或几种。称取该样品1.000克,溶于水配成100mL溶液,将溶液分成两等份依次完成如下实验:
①向一份溶液中加入10mL0.2 mol·L-1的盐酸与之充分反应,可收集到标准状况下的CO2气体44.8mL(设产生的CO2全部逸出)。
②向另一份溶液中加入足量的6mol·L-1氢氧化钠溶液,加热,产生的气体(设产生的NH3全部逸出)至少需要25mlL0.15 mol·L-1的硫酸才能被完全反应。下列说法正确的是
A. 1.000g样品中一定含有NH4HCO30.316克
B. 向①反应所得的溶液中加入硝酸酸化的硝酸银溶液,若有白色沉淀生成,说明原样品中一定含有NH4Cl
C. 原样品的含氨量为21%
D. 无需另外再设计实验验证,就能确定原样品中是否含有NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)已知碘元素最终变为无色HIO3。上述整个过程中的还原剂是_______________________。写出CCl4层变成紫色的离子反应方程式________________________________________。
(2)若把KI换成KBr,则CCl4层变为_________色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是______________________________________。
(3)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。试配平该反应的化学方程式,并用短线标出电子转移方向及总数__NaIO3+NaHSO3→NaHSO4+Na2SO4+I2+_H2O,已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备试验时,定时取样,并用酸化的氯化钡来检测SO42-离子生成的量,发现开始阶段反应速度呈递增的趋势,试简述这变化趋势发生的原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ(1)用CCl4萃取碘水中的碘,下图的分液漏斗中,下层液体呈______色;打开分液漏斗活塞,却未见液体流下,原因可能是_____。

Ⅱ 某同学用某种粗盐进行提纯实验,步骤见下图。

请回答下列问题:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是______________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了____________,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | _______ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | _____ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,________ | _______ | 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于臭氧性质的叙述中,不正确的是
A.臭氧比氧气的氧化性更强,常温下能将银、汞等较不活泼的金属氧化
B.臭氧是比氯水更好的消毒剂,因为它在消灭细菌后变成O2,无污染
C.臭氧和活性炭一样,能够吸附有机色素,是种很好的漂白剂
D.臭氧和氧气在一定条件下可以相互转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com