
����Ŀ����̼���������������Ⱦ�������Դͷ�϶�β�����о����������ش���������
��1������β����ת�����еķ�ӦΪ2NO��g��+2CO��g��![]() 2CO2��g��+N2��g���������ܱ������з����÷�Ӧʱ��c��N2�����¶ȣ�T����ʱ�䣨t���ı仯������ͼ��ʾ��
2CO2��g��+N2��g���������ܱ������з����÷�Ӧʱ��c��N2�����¶ȣ�T����ʱ�䣨t���ı仯������ͼ��ʾ��
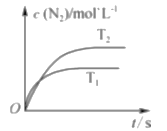
����ͼ��֪���¶�T1_____T2���������������ͬ�����÷�Ӧ�ġ�H_____0��
�������β��ת���ʵĴ�ʩ��_____������ĸ����
a�������¶� b�������¶� c������ѹǿ d����������ıȱ����
��2��úȼ�ղ����������к��е����������CH4����ԭNOx�����������������Ⱦ����֪����CH4��g��+2NO2��g����N2��g��+CO2��g��+2H2O��g����H����867kJmol��1����N2O4��g��2NO2��g����H��+56.9kmol��1����CH4��g��+N2O4��g����N2��g��+CO2��g��+2H2O��g����H����810.1kJmol��1����ԭ��صĹ���ԭ�������������Ϊԭ��صķ�ӦΪ_____������ţ���
��3����ͼ��ͨ�����ת��ԭ������ȼú�����Ķ�����̼Ϊԭ�ϣ��Ʊ��²�Ʒ��ʾ��ͼ����д�����ת���������ܷ�Ӧ�Ļ�ѧ����ʽ��_____������a��b֮�����ӵ����ϵĵ���������_____��
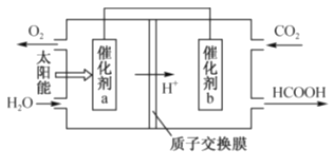
���𰸡��� �� bc �٢� 2CO2+2H2O![]() 2HCOOH+O2 b��a
2HCOOH+O2 b��a
��������
��1�������ȹ���ƽ��ֵ���¶�Խ�ߣ���Ӧ�ٶ�Խ�죬Խ�ȴﵽƽ�⣻��ͼ�п�֪�¶�T1ʱ�ȴﵽƽ�⣬��T1>T2��T1�¶ȸߣ�����ƽ��ʱc(N2)��T2ʱ�ͣ�˵�������¶ȣ������ƶ����淴ӦΪ���ȷ�Ӧ��������ӦΪ���ȷ�Ӧ����H<0����Ϊ�� ����
�����β��ת���ʣ���Ӧ�������ƶ���a�������¶ȣ������ƶ������������⣻b�������¶ȣ������ƶ����������⣻c������ѹǿ�������������С�ķ�Ӧ�ƶ���Ϊ����Ӧ���������⣻d����������ıȱ������������Ӱ��ƽ�⣬ƽ�ⲻ�ƶ�����Ϊbc��
��2��Ҫ���ԭ��أ�����Ҫ�Է���������ԭ��Ӧ����Ӧ�٢ڢ۾�Ϊ������ԭ��Ӧ���Է�Ϊ��H<0���٢۷���Ҫ��Ϊ�٢ۣ�
��3����ͼ��֪����Ӧ��ΪCO2��H2O������ΪHCOOH��O2������������ԭ��Ӧ��ƽ������ʽ2CO2+2H2O![]() 2HCOOH+O2��a�缫��H2O���O2�����ϼ����ߣ�ʧȥ���ӣ����Ӵ�a��b����ô������Ӧ����Ϊb��a����Ϊ2CO2+2H2O
2HCOOH+O2��a�缫��H2O���O2�����ϼ����ߣ�ʧȥ���ӣ����Ӵ�a��b����ô������Ӧ����Ϊb��a����Ϊ2CO2+2H2O![]() 2HCOOH+O2 b��a��
2HCOOH+O2 b��a��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���X�Ľṹ��ʽ��ͼ��ʾ���������й�˵������ȷ����
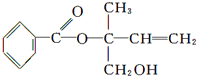
A. X�ķ���ʽΪC12H16O3
B. �������Ը��������Һ���ֱ���X
C. X��һ���������ܷ����ӳɡ��Ӿۡ�ȡ������ȥ�ȷ�Ӧ
D. ��Ni�������������£�1 mol X���ֻ����1 mol H2�ӳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ��ԭ��(����ĸ��ʾ)������������ԭ�������Ĺ�ϵͼ������˵������ȷ���ǣ� ��
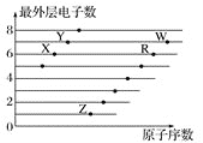
A.�⻯��е㣺H2X��H2R
B.���������ԣ�HWO��H2RO4
C.��̬�⻯����ȶ��ԣ�HY��HW��H2R
D.���Ӱ뾶��R2-��X2-��Y-��Z+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС����ʵ�����н��л�ѧʵ�飬����ͼ�����Ӻ���·���ֵ��ݲ�������ͼ�����Ӻ���·���ֵ��������ɴ˵ó��Ľ�����ȷ����(����)

A.NaCl��Һ�ǵ����
B.��ͨ��������£�NaCl��ˮ�е�������������Ӷ�����
C.NaCl���������������ӣ���˲��ܵ���
D.ͬһ�¶��£�������NaCl��Һ���ɵ�Ũ�ȵ�MgCl2��Һ����Һ��������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(AlN)��һ�����������ϣ��㷺Ӧ���ڵ��ӡ��մɵȹ�ҵ������һ�������£�AlN��ͨ����ӦAl2O3+N2+3C![]() 2AlN+3CO�ϳɡ���֪AlN����NaOH��Һ��Ӧ�ų��д̼�����ζ�����塣����������ȷ����(����)
2AlN+3CO�ϳɡ���֪AlN����NaOH��Һ��Ӧ�ų��д̼�����ζ�����塣����������ȷ����(����)
A.AlN�е�Ԫ�صĻ��ϼ�Ϊ+3
B.������Ӧ�У�N2�ǻ�ԭ����Al2O3��������
C.������Ӧ�У�ÿ����1molAlN��ת��6mol����
D.AlN��NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ��AlN+NaOH+H2O=NaAlO2+NH3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25 ��ʱ��Ka(HF)��3.6��10��4��Ksp(CaF2)��1.46��10��10������1 L 0.2 mol��L��1HF��Һ�м���1 L 0.2 mol��L��1 CaCl2��Һ��������˵��������ȷ����
A. 25 ��ʱ��0.1 mol��L��1 HF��Һ��pH��1
B. Ksp(CaF2)���¶Ⱥ�Ũ�ȵı仯���仯
C. ����ϵ��û�г�������
D. ����ϵ��HF��CaCl2��Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�ڳ����¾�Ϊ���Է���Ӧ���ڸ�������Ϊ���Է���Ӧ����
A. Ag2O(s)===2Ag(s)��![]() O2(g)
O2(g)
B. Fe2O3(s)��![]() C(s)===2Fe(s)��
C(s)===2Fe(s)��![]() CO2(g)
CO2(g)
C. N2O4(g)===2NO2(g)
D. 6C(s)��6H2O(l)===C6H12O6(s)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ�����ȡ���ϡ��㾫��Ⱦ�ϡ�Ϳ�ϡ�ϴ�Ӽ��Ȳ�Ʒ��ԭ�ϣ�
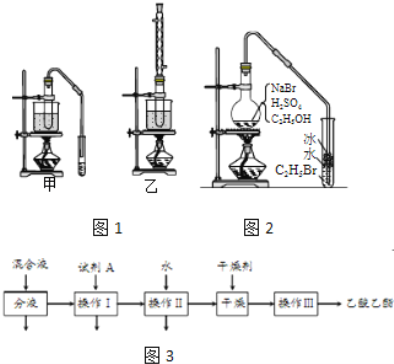
���������գ�
��1��ʵ�������Ҵ���ȡ��ϩʱ��Ũ���������ԶԶ������Ϊ����������������ԭ����______��
��2����֤��ϩ�ӳɷ�Ӧ����ʱ�������ϩ�����еĸ������ʽ��д�������ѡ�õ��Լ���______����д��ѧʽ������ȷ����ϩͨ����ˮ�з����˼ӳɷ�Ӧ����ʵ��______����ѡ���ţ�
a����ˮ��ɫ b������״��������
c����Ӧ��ˮ��Һ������ǿ d����Ӧ��ˮ��Һ�ӽ�����
��3��ʵ�������Ҵ��������Ʊ���������ʱ����������װ����ͼ1������ѡ�ã�����������װ�õ�˵����ȷ����______����ѡ���ţ�
���� | �е㣨�棩 |
�Ҵ� | 78.5 |
���� | 117.9 |
�������� | 77 |
a����װ������ת���ʸ� b����װ������ת���ʸ�
c����װ��������������ʩ d����װ��������������ʩ
��4������װ��ʵ��ʱ���ᴿ��������������������ͼ3�������������Լ�A�Ļ�ѧʽ��______����������������______��������һ�������ڷ���______����
��5����ͼ2�����Ҵ��Ʊ��������װ�ã�ʵ���������ּ��Ϸ�����
���ȼ��廯�����ټ��Ҵ�������1��1Ũ���
���ȼ��廯�����ټ�1��1Ũ�����������Ҵ���
�������ٺ͢�ʵ��ʱ�����ﶼ��������ɫ�������Թ��м���______������ɱ�Ϊ��ɫ���뷽������Ƚϣ������ڵ�����ȱ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����ڷ�Ӧ2SiHCl3(g)===SiH2Cl2(g)��SiCl4(g)�����ô�������������ӽ�����֬��������323 K��343 KʱSiHCl3��ת������ʱ��仯�Ľ����ͼ��ʾ��

��343 Kʱ��Ӧ��ƽ��ת��������________%��ƽ�ⳣ��K343 K��________(����2λС��)��
����343 K�£�Ҫ���SiHCl3ת���ʣ��ɲ�ȡ�Ĵ�ʩ��________��Ҫ���̷�Ӧ�ﵽƽ���ʱ�䣬�ɲ�ȡ�Ĵ�ʩ��________��________��
���Ƚ�a��b����Ӧ���ʴ�С��va________vb(������������С��������������)����Ӧ����v��v����v����k��x2SiHCl3��k��xSiH2Cl2xSiCl4��k����k���ֱ�Ϊ��������Ӧ���ʳ�����xΪ���ʵ�������������a����v��/v����________(����1λС��)��
��2����ͬ�¶���ˮ�����ӻ����������ʾ��
t/�� | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
���������ֽ������¶�����ˮ�����ӻ������ԭ��_______________��
��10��ʱ��ˮ�ĵ���ƽ�ⳣ��Ϊ_________������100��ʱ��ˮ�е��������������Ũ��Ϊ__________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com