
| A、稀硫酸滴在铁片上:2Fe+6H+=Fe3++3H2↑ |
| B、过量的CO2通入澄清的石灰水中:CO2+OH-=HCO3- |
| C、碳酸钙溶于足量的盐酸中:CO32-+2H+=H2O+CO2↑ |
| D、过量的NaHCO3溶液与Ca(OH)2溶液混合:Ca2++HCO3-+OH-=CaCO3↓+H2O |


科目:高中化学 来源: 题型:
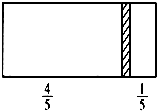 在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分.当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同).则混合气体中CO和CO2的分子个数比为( )
在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分.当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同).则混合气体中CO和CO2的分子个数比为( )| A、1:1 | B、1:3 |
| C、2:1 | D、3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M与X形成的化合物对应的水化物一定是强酸 |
| B、Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 |
| C、X、Y的简单离子半径:r(X2-)>r(Y+) |
| D、M的气态氢化物比N的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B、欲配置1.00L,1.00mol?L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
| C、标准状况下,11.2L CH3CH2OH中含有分子的数目为0.5NA |
| D、常温常压下,8g氧气含有4NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标况下,0.3 mol的NH3 |
| B、4℃时,18克水 |
| C、2mol的Al (密度为2.7g/cm3 ) |
| D、100g 37% 密度1.20 g/cm3 NaCl 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
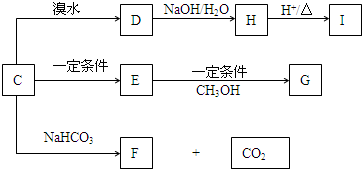
查看答案和解析>>
科目:高中化学 来源: 题型:
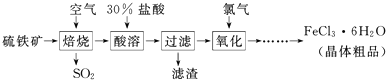
| △ |
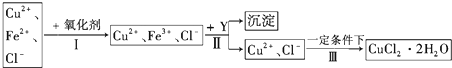
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com