
【题目】多晶硅是制作光伏电池的关键材料。将SiCl4氢化为SiHCl3的热化学方程式为:3SiCl4+2H2(g)+Si(s)![]() 4SiHCl3(g) △H2<0
4SiHCl3(g) △H2<0
(1)该反应是____________反应(填吸热、放热)
(2)在相同条件,相同时间t时,不同温度下该反应中SiCl4转化率如图所示。下列叙述正确的是________________(填序号)。
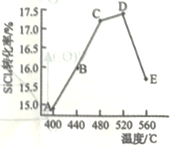
a.相同时间t内,A点的平均反应速率大于B点
b.相同时间t时,B点:v正>v逆
c.相同时间t时,v逆:C点大于A点
d.工业生产中采用了适宜温度:480~520°C
(3)为了增大化学反应速率,除加入催化剂、升高温度外还可以采用哪些方法和措施:___。(只写出一条)
【答案】放热 bcd 将固体Si粉碎增大接触面积、增大反应物浓度、加入反应物增大压强(只填增大压强不得分)
【解析】
(1) 已知△H2<0,则该反应为放热反应;
(2) a.相同时间t内,A点的温度小于B点,则A点的平均反应速率小于B点,与题意不符,a错误;
b.相同时间t时,B点未达到平衡状态,反应正向进行,则v正>v逆,符合题意,b正确;
c.相同时间t时,C点的温度大于A点,则v逆:C点大于A点,符合题意,c正确;
d.根据图像可知,温度在480~520°C时,SiCl4的转化率最高,则工业生产中采用了适宜温度:480~520°C,符合题意,d正确;
(3) 将固体Si粉碎增大接触面积、增大反应物浓度、加入反应物增大压强均可提高反应速率。
(1) 已知△H2<0,则该反应为放热反应;
(2) a.相同时间t内,A点的温度小于B点,则A点的平均反应速率小于B点,与题意不符,a错误;
b.相同时间t时,B点未达到平衡状态,反应正向进行,则v正>v逆,符合题意,b正确;
c.相同时间t时,C点的温度大于A点,则v逆:C点大于A点,符合题意,c正确;
d.根据图像可知,温度在480~520°C时,SiCl4的转化率最高,则工业生产中采用了适宜温度:480~520°C,符合题意,d正确;
答案为bcd;
(3) 将固体Si粉碎增大接触面积、增大反应物浓度、加入反应物增大压强均可提高反应速率。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】阅读有关硫代硫酸钠(Na2S2O3)的相关资料:
硫代硫酸钠是一种白色的晶体,可用作冲洗照相底片的定影剂、棉织物漂白后的脱氯剂及定量分析中的还原剂。它在碱性环境中能稳定存在,在酸性条件下发生反应生成SO2和S。制备Na2S2O3的方法很多,常用的方法有:Ⅰ.将纯碱溶解后,与二氧化硫作用生成亚硫酸钠,再加入硫磺沸腾反应,经过滤、浓缩、结晶,制得五水硫代硫酸钠(Na2S2O3·5H2O)。Ⅱ.硫化碱法:利用碳酸钠、硫化钠和废气中的二氧化硫反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。Ⅲ.氧化、亚硫酸钠和重结晶法:由含硫化钠、亚硫酸钠和烧碱的液体经加硫氧化……。
回答下列问题:
(1)Na2S2O3和HCl反应的离子方程式___。
(2)方法Ⅰ中所包含的反应___(写方程式)。
(3)方法Ⅱ中做氧化剂的物质是___(化学式),做还原剂的是__(化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图三条曲线表示不同温度下水的离子积常数,下列说法不正确的是
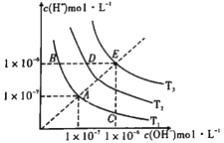
A. 图中温度:T3>T2>T1
B. 图中pH关系是:pH(B)=pH(D)=pH(E)
C. 图中五点Kw间的关系:E>D>A=B=C
D. C点可能是显酸性的盐溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.棉花、麻、羊毛、蚕丝的主要化学成分都是蛋白质
B.淀粉、纤维素、氨基酸、蛋白质在一定条件下都能水解
C.皂化反应完全后,向反应液中加入热的饱和食盐水,容器底部有固体析出
D.可用水鉴别乙醇、苯和四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是
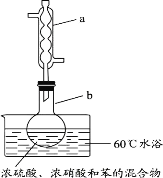
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.仪器a的作用是冷凝回流,提高原料的利用率
C.浓硫酸、浓硝酸和苯混合时,应先向浓硫酸中缓缓加入浓硝酸,待冷却至室温后,再将苯逐滴滴入
D.反应完全后,可用蒸馏的方法分离苯和硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数![]() 随溶液pH的变化曲线如下图所示。下列说法正确的是( )
随溶液pH的变化曲线如下图所示。下列说法正确的是( )
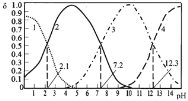
A.曲线1和曲线2分别表示![]() (H3PO4)和
(H3PO4)和![]() (HPO42-)的变化
(HPO42-)的变化
B.25℃时,H3PO4的电离常数K1=10-2.1
C.pH=7.2时,溶液中c(H2PO4-)+c(HPO42-)+c(OH-)=c(Na+)+c(H+)
D.pH=12.3时,溶液中由水电离出的c(H+)=10-12.3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10 mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未两出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是( )
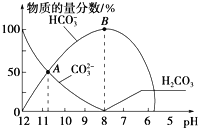
A.在0.1 mol/L Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B.在B点所示的溶液中,浓度最大的离子是Na+
C.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-)
D.当溶液的pH为7时,溶液的总体积为20mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随加入的c(HC2O4-)的变化趋势如图所示。下列说法正确的是( )
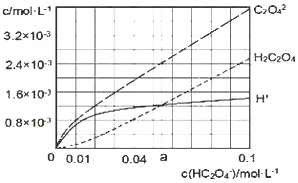
A.当c(HC2O4-)=0.1 mol/L时,c(H+)>c(C2O42-)-c(H2C2O4)
B.当c(HC2O4-)>a mol/L时,c(H+)<c(H2C2O4),HC2O4-的水解程度大于电离程度
C.HC2O4-![]() C2O42-+H+,Ka(HC2O4-)=a
C2O42-+H+,Ka(HC2O4-)=a
D.将0.08 mol/LH2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K=![]() 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A. 当混合气体的平均相对分子质量保持不变时,反应达平衡
B. 增大压强,各物质的浓度不变
C. 升高温度,平衡常数K增大
D. 增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com