


科目:高中化学 来源: 题型:
| A、K+、Ba2+、NO3-、Cl- |
| B、H+、Fe2+、ClO-、Cl- |
| C、Na+、Ag+、Cl-、SO42- |
| D、Al3+、Na+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学平衡不发生移动 |
| B、化学平衡向正反应方向移动 |
| C、化学平衡向逆反应方向移动 |
| D、正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、1:2 |
| C、1:1 | D、1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
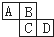 如图为周期表中的一部分.已知A、B、C、D均为短周期元素,A与D原子序数之和为C原子序数的1.5倍.
如图为周期表中的一部分.已知A、B、C、D均为短周期元素,A与D原子序数之和为C原子序数的1.5倍.查看答案和解析>>
科目:高中化学 来源: 题型:
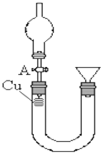 某研究性学习小组设计实验方案来研究稀硝酸与铜反应生成NO.
某研究性学习小组设计实验方案来研究稀硝酸与铜反应生成NO.查看答案和解析>>
科目:高中化学 来源: 题型:
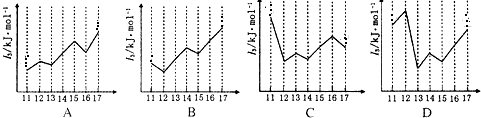
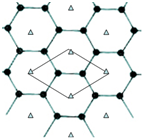
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com