
 某化学兴趣小组的同学为测定石灰石样品中碳酸钙的含量(杂质不溶于水也不溶于酸),同学们取石灰石样品16克,放入68.4克盐酸中,测得物质总质量的变化如图所示,求:
某化学兴趣小组的同学为测定石灰石样品中碳酸钙的含量(杂质不溶于水也不溶于酸),同学们取石灰石样品16克,放入68.4克盐酸中,测得物质总质量的变化如图所示,求:| 10 |
| 44 |
| x |
| 4.4 |
| 111 |
| y |
| 44 |
| 4.4 |
| 11.1g |
| 74g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
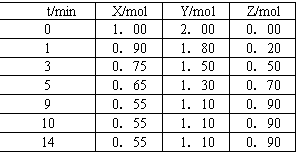
| A、分别滴加0.1 mol?L-1的盐酸,看气泡产生的快慢 |
| B、分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色沉淀生成 |
| C、分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 |
| D、分别配成溶液,做焰色反应实验,观察火焰的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
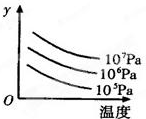 有某可逆反应aA(g)+bB(g)cC(g);△H=Q kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )
有某可逆反应aA(g)+bB(g)cC(g);△H=Q kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )| A、a+b<c时,y轴表示平衡混合气中C的质量分数 |
| B、a+b>c时,y轴表示平衡混合气的平均摩尔质量 |
| C、Q>0时,y轴表示达到平衡时B的转化率 |
| D、Q<0时,y轴表示达到平衡时A的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
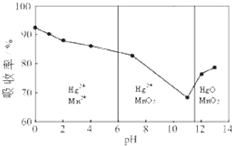 (一)电解饱和食盐水的阳极产物是
(一)电解饱和食盐水的阳极产物是查看答案和解析>>
科目:高中化学 来源: 题型:
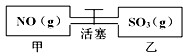 如图,容积相等的甲乙两个容器,通过活塞相连,分别充入NO和SO3且使气体密度相等.打开活塞使气体充分混合,发生反应:SO3(g)+NO(g)?SO2(g)+NO2(g)并达到平衡.反应过程中两容器的温度恒定且相等.则打开活塞前后,容器甲中保持不变的是( )
如图,容积相等的甲乙两个容器,通过活塞相连,分别充入NO和SO3且使气体密度相等.打开活塞使气体充分混合,发生反应:SO3(g)+NO(g)?SO2(g)+NO2(g)并达到平衡.反应过程中两容器的温度恒定且相等.则打开活塞前后,容器甲中保持不变的是( )| A、气体的密度 |
| B、气体分子数 |
| C、气体压强 |
| D、气体平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容量瓶刚用蒸馏水洗净,没有烘干 |
| B、没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中 |
| C、定容时滴加蒸馏水先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切 |
| D、定容时仰视刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com