
【题目】向100 mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:

(1)加入B溶液110 mL时,溶液中的沉淀是______,溶液中的溶质是__________。
(2)从90 mL至100mL之间加入10mL B溶液时发生的离子反应方程式是:Ba2++ SO42—=BaSO4↓,Al(OH)3+ OH— =AlO2— +2H2O,溶液B中Na2SO4与NaOH的物质的量浓度之比为____;
(3)计算A溶液中AlCl3的物质的量浓度,_______________写出计算过程)
【答案】BaSO4、Fe(OH)3 N aCl、NaAlO2、Na2SO4 1:1 加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解,溶解了0.1molAl(OH)3,消耗了10mLB溶液,故c(NaOH)=![]() =10mol/L;90-110mLB溶液时氢氧化铝完全溶解,消耗了20mL氢氧化钠溶液,参加反应的氢氧根离子的物质的量为:10mol/L×0.02L=0.2mol,根据反应Al(OH)3+OH-=AlO2-+2H2O可知,原溶液中铝离子的总物质的量为0.2mol,则氯化铝的物质的量为0.2mol,其浓度为:
=10mol/L;90-110mLB溶液时氢氧化铝完全溶解,消耗了20mL氢氧化钠溶液,参加反应的氢氧根离子的物质的量为:10mol/L×0.02L=0.2mol,根据反应Al(OH)3+OH-=AlO2-+2H2O可知,原溶液中铝离子的总物质的量为0.2mol,则氯化铝的物质的量为0.2mol,其浓度为:![]() ==2mol/L。
==2mol/L。
【解析】
图中第一段曲线生成的沉淀为BaSO4、Fe(OH)3和Al(OH)3,且加入B溶液90mL时,Fe3+、Al3+恰好沉淀完全;
图中第二段曲线为平行直线,沉淀总物质的量没有增减,故这段是由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等;
图中第三段曲线中,加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解;
图中第四段曲线中,沉淀为Fe(OH)3、BaSO4共1.1mol,据此对各选项进行解答。
第一段曲线生成的沉淀为BaSO4、Fe(OH)3和Al(OH)3,且加入B溶液90mL时,Fe3+、Al3+恰好沉淀完全;第二段曲线为平行直线,沉淀总物质的量没有增减,故这段是由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等;第三段曲线中,加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解;第四段曲线中,沉淀为Fe(OH)3、BaSO4共1.1mol,
(1)根据分析可知,加入110mLB溶液时,剩余的沉淀为Fe(OH)3、BaSO4的混合物,根据质量守恒可知溶质为NaCl、NaAlO2、Na2SO4;
故答案为:Fe(OH)3、BaSO4;NaCl、NaAlO2、Na2SO4;
(2)加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解,溶解了0.1molAl(OH)3,消耗了10mLB溶液,故c(NaOH)=![]() =10mol/L;加入的90mLB溶液中含有氢氧根离子的物质的量为:10mol/L×0.09mol=0.9mol,生成氢氧化铝、氢氧化铁沉淀的物质的量为:0.9mol×
=10mol/L;加入的90mLB溶液中含有氢氧根离子的物质的量为:10mol/L×0.09mol=0.9mol,生成氢氧化铝、氢氧化铁沉淀的物质的量为:0.9mol×![]() =0.3mol,生成硫酸钡沉淀的物质的量为:1.2mol-0.3mol=0.9mol,故c(Na2SO4)=
=0.3mol,生成硫酸钡沉淀的物质的量为:1.2mol-0.3mol=0.9mol,故c(Na2SO4)=![]() =10mol/L,所以B溶液中Na2SO4和NaOH的物质的量浓度之比为1:1;
=10mol/L,所以B溶液中Na2SO4和NaOH的物质的量浓度之比为1:1;
故答案为:1:1;
(3)由以上分析可知,c(NaOH)=![]() =10mol/L;90-110mLB溶液时氢氧化铝完全溶解,消耗了20mL氢氧化钠溶液,参加反应的氢氧根离子的物质的量为:10mol/L×0.02L=0.2mol,根据反应Al(OH)3+OH-=AlO2-+2H2O可知,原溶液中铝离子的总物质的量为0.2mol,则氯化铝的物质的量为0.2mol,其浓度为:
=10mol/L;90-110mLB溶液时氢氧化铝完全溶解,消耗了20mL氢氧化钠溶液,参加反应的氢氧根离子的物质的量为:10mol/L×0.02L=0.2mol,根据反应Al(OH)3+OH-=AlO2-+2H2O可知,原溶液中铝离子的总物质的量为0.2mol,则氯化铝的物质的量为0.2mol,其浓度为:![]() =2mol/L;
=2mol/L;
故答案为:2mol/L。


科目:高中化学 来源: 题型:
【题目】如图所示为科学家正在研发的新型电池,该电池容量大,电流稳定等多方面优点。该电池的电池总反应式为:Na(1-x)MO2+NaxCn![]() NaMO2+nC,下列说法正确的是( )
NaMO2+nC,下列说法正确的是( )
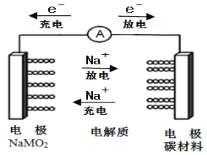
A.电池充电时,NaMO2电极为阳极
B.放电时,负极反应式:NaMO2-xe-=Na(1-x)MO2+xNa+
C.电解质可以选用无水乙醇
D.充电时,阳极反应式为:nC+xNa++xe-=NaxCn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) | 10 | 20 | 30 | 50 | 70 |
pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
(1)甲同学认为,该溶液pH升高的原因是HCO3-的水解程度增大,碱性增强,该反应的离子方程式为____________________。
(2)乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________ (填“大于”或“小于”)NaHCO3的水解程度。
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液的pH,若pH______8.3(填“>”“<”或“=”,下同),说明甲同学正确;若_______8.3,说明乙同学正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合图像的是

A.2SO3(g) ![]() 2SO2(g)+O2(g) △H=+Q2kJ·mol-1(Q2>0)
2SO2(g)+O2(g) △H=+Q2kJ·mol-1(Q2>0)
B.H2(g)+CO(g) ![]() C(s)+H2O(g) △H=+Q4kJ·mol-1(Q4>0)
C(s)+H2O(g) △H=+Q4kJ·mol-1(Q4>0)
C.N2(g)+3H2(g) ![]() 2NH3(g) △H =-Q1kJ·mol-1 (Q1>0)
2NH3(g) △H =-Q1kJ·mol-1 (Q1>0)
D.4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H =-Q3kJ·mol-1 (Q3>0)
4NO(g)+6H2O(g) △H =-Q3kJ·mol-1 (Q3>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
(1)氯化铁溶液腐蚀铜板的离子方程式: ______ .
(2)将5至6滴饱和氯化铁溶液滴入到25mL沸水中,继续加热,得红褐色液体.
写出反应的离子方程式: ______ .
(3)向100mL![]() 硫酸铝铵
硫酸铝铵![]() 溶液中逐滴滴入
溶液中逐滴滴入![]()
![]() 溶液.随着
溶液.随着![]() 溶液体积V的变化,沉淀物质的量n的变化如图所示:
溶液体积V的变化,沉淀物质的量n的变化如图所示:
①请认真思考,写出相应的离子方程式:
OA段: ______
OB段: ______
BC段: ______
CD段: ______

②当![]() 离子恰好全部沉淀时,生成
离子恰好全部沉淀时,生成![]() 物质的量为 ______ mol.
物质的量为 ______ mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属混合物粉末15 g与足量的盐酸反应时生成标准状况下11.2 L氢气,符合上述情况的金属混合物
A.Mg、FeB.Zn、AgC.Zn、FeD.Mg、Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是工业上制取纯硅的一种方法。

请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有____(填反应代号);
(2)写出反应③的化学方程式____;
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂。将石英砂和纯碱按一定比例混合加热至1 373~1 623 K反应,生成化合物W,其化学方程式是____;
(4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是___(填化学式);分别通入W溶液中能得到白色沉淀的气体是___(填化学式);
(5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HBr是一种重要的工业原料,可以用来生产医用药品,合成染料或香料,用作石油化工的催化剂等。如图是工业制备HBr的一种生产流程:

(1)气体a是燃煤工业的烟道气和工业生产硫酸的尾气的成分,结合框图信息可判断气体a的分子式为___。混合物①中加的水为___(填“冰水”或“热水”),原因是___。
(2)试剂b为含氯的盐,b为___(用化学式表示),混合②的目的是___。第二次蒸馏后的“含c的溶液”中c为___。
(3)生产流程中操作A的名称___,实验室中蒸馏操作是在___中进行的。(填玻璃仪器名称)
(4)工业生产中制得的氢溴酸带有淡淡的黄色。于是甲、乙两同学设计了实验加以探究:①甲同学假设工业氢溴酸呈淡黄色是因为含有Fe3+,则用于证明该假设所用的试剂为___(填化学式),若假设成立可观察到的现象为___。
②乙同学假设工业氢溴酸呈淡黄色是因为其中含有杂质___,用于证明该假设成立的方法为___(简单写出实验步骤)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com