
【题目】![]() 在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
(1)氯化铁溶液腐蚀铜板的离子方程式: ______ .
(2)将5至6滴饱和氯化铁溶液滴入到25mL沸水中,继续加热,得红褐色液体.
写出反应的离子方程式: ______ .
(3)向100mL![]() 硫酸铝铵
硫酸铝铵![]() 溶液中逐滴滴入
溶液中逐滴滴入![]()
![]() 溶液.随着
溶液.随着![]() 溶液体积V的变化,沉淀物质的量n的变化如图所示:
溶液体积V的变化,沉淀物质的量n的变化如图所示:
①请认真思考,写出相应的离子方程式:
OA段: ______
OB段: ______
BC段: ______
CD段: ______

②当![]() 离子恰好全部沉淀时,生成
离子恰好全部沉淀时,生成![]() 物质的量为 ______ mol.
物质的量为 ______ mol.
【答案】![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
(1)Fe3+有强氧化性,能把金属铜氧化成铜离子;
(2)向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色,即制得Fe(OH)3胶体;
(3)①100mL 0.1molL-1硫酸铝铵[NH4Al(SO4)2],根据它的物质的量.计算出溶液含有NH4+,Al3+,SO42-的物质的量,根据消耗的氢氧化钡的物质的量和沉淀的物质的量关系可以确定OA段是生成硫酸钡的反应,OB段是铝离子完全沉淀的反应,BC段沉淀的量没变,BC是消耗铵根的反应,CD段是沉淀减少的过程,CD溶解氢氧化铝的反应,根据分析写出离子方程式;
②OA段是生成硫酸钡的反应,加入200ml氢氧化钡时,达到氢氧化铝的沉淀最大量,氢氧化铝没有溶解,图像上可以读出氢氧化铝的物质的量。
(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+;
(2)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,反应的化学方程式为:![]() ;
;
(3)①100mL0.1molL-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol,关键弄清楚反应顺序,开始滴加氢氧化钡溶液,同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-0.02mol ,SO42-+Ba2+=BaSO4↓,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到B),再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液;
②根据以上分析不难得出,OA段是生成硫酸钡的反应,OB段是铝离子完全沉淀的反应,BC是消耗铵根的反应,CD溶解氢氧化铝的反应,根据以上分析不难得出,当SO42-离子恰好全部沉淀时,加入0.02molBa(OH)2,这时根据图象氢氧化铝没有开始溶解,故生成Al(OH)3物质的量仍为0.01mol。


科目:高中化学 来源: 题型:
【题目】A、B、C三种短周期元素,原子序数依次增大,三种元素原子序数之和为36,A、C同族,B2+离子核外有10个电子,回答下列问题:
(1)A、B、C三种元素的符号分别是_________、_________、_________
(2)A、B、C之间任取两种能形成多种化合物,其中属于共价化合物的化学式分别为_________、___________
(3)分别写出A、B的电子排布式:A_________、B________
(4)写出C的价电子轨道排布图:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL 0.2000mol/L NH4Cl溶液中逐滴加入0.2000mol/L NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法中正确的是( )

A.a点溶液中:c(H+) + c(NH4+) = c(OH-) + c(NH3·H2O)
B.b点溶液中:c(Cl-) = c(Na+) > c(H+) = c(OH-)
C.c点溶液中:c(NH3·H2O) + c(NH4+) = c(Cl-) + c(OH-)
D.d点溶液中:(Cl-) > c(NH3·H2O) > c(OH-) > c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡H2S ![]() HS-+H+和HS-
HS-+H+和HS- ![]() S2-+H+,若向溶液中
S2-+H+,若向溶液中
A.加硫酸,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.通入氯气,溶液pH值增大
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:

(1)加入B溶液110 mL时,溶液中的沉淀是______,溶液中的溶质是__________。
(2)从90 mL至100mL之间加入10mL B溶液时发生的离子反应方程式是:Ba2++ SO42—=BaSO4↓,Al(OH)3+ OH— =AlO2— +2H2O,溶液B中Na2SO4与NaOH的物质的量浓度之比为____;
(3)计算A溶液中AlCl3的物质的量浓度,_______________写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的自动化检测中常常应用根据原电池原理设计的传感器。下图为电池的工作示意图,气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。
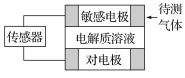
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
则下列说法中正确的是
A. 上述气体检测时,敏感电极均作电池负极
B. 检测Cl2气体时,敏感电极的电极反应式为Cl2+2e-===2Cl-
C. 检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-===4OH-
D. 检测Cl2和CO体积分数相同的两份空气样本时,传感器上电流大小、方向相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2molNaHCO3和一定量的Na2O2固体混合,在加热的条件下使其反应,经测定无Na2O2剩余,则最后所得固体的物质的量(n)为
A.1mol<n≤2molB.1mol<n≤4molC.2mol<n≤4molD.n>4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将大气中的氮气活化合成氨是维持地球上生命所必需的转化过程,最近我国成功研制出高效电催化固氮催化剂Mo2N,它的研制成功能有效提高氮肥生产效率。
回答下列问题:
(1)钼(Mo)位于第五周期,与铬同副族,则Mo的价电子排布式为______________。
(2)基态氮原子核外电子空间运动状态有____种,氮元素所在周期中第一电离能最大的前三种元素依次是____(按由大到小的顺序写)。
(3)氮元素能形成一系列的化合物,如NH3、HN3(结构式为![]() )、H2NCH2COOH等。NH3的分子构型为________,HN3结构式中间两个氮原子的杂化轨道类型为________,1个HN3分子中含______个π键;H2NCH2COOH(熔点为182 ℃)、CH3CH2COOH(熔点为22 ℃)的相对分子质量几乎相同,但熔点相差很大,从物质结构的角度分析,导致该现象的主要原因是______。
)、H2NCH2COOH等。NH3的分子构型为________,HN3结构式中间两个氮原子的杂化轨道类型为________,1个HN3分子中含______个π键;H2NCH2COOH(熔点为182 ℃)、CH3CH2COOH(熔点为22 ℃)的相对分子质量几乎相同,但熔点相差很大,从物质结构的角度分析,导致该现象的主要原因是______。
(4)氮与铂元素形成的某种化合物晶胞如图所示,则该化合物的化学式为______,若该晶胞的边长为d pm,则晶体的密度为____ g/cm3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com