
【题目】蔗糖酯是联合国国际粮农组织和世界卫生组织推荐使用的食品乳化剂. 某蔗糖酯由蔗糖与硬脂酸乙酯合成, 反应如图所示。有关说法正确的是

A.蔗糖酯也高级脂酸的甘油酯
B.合成该蔗糖酯的反应属于取代反应
C.蔗糖分子中含有7个羟基
D.该蔗糖酯在稀硫酸的作用下水解,水解过程中只有硬脂酸和葡萄糖两种产物
科目:高中化学 来源: 题型:
【题目】下列关于溶液的说法中正确的是
A.pH=7的溶液中,Na+、NH4+、CH3COO-、NO3-可以大量共存
B.Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9,任何条件下二者不可能相互转化
C.1mol/LNa2SO4溶液中阴离子数目大于1mol/LNa2CO3溶液中阴离子数目
D.Na2S溶液与FeC13溶液混合后产生沉淀,该沉淀一定是Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要的农药、医药中间体-碱式氯化铜[CuaClb(OH)c·xH2O],可以通过以下步骤制备。步骤 1:将铜粉加入稀盐酸中,并持续通空气反应生成 CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示。步骤2:在制得的CuCl2溶液中,加入石 灰乳充分反应后即可制备碱式氯化铜。下列有关说法不正确的是

A.图中M、N分别为Fe2+、Fe3+
B.a、b、c 之间的关系式为:2a=b+c
C.步骤1充分反应后,加入少量CuO是为了除去Fe3+
D.若制备1 mol的CuCl2,理论上消耗标况下11.2 LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用两种不饱和烃A和D为原料可以合成一类新药有机物J ,合成路线如下:

已知①
②有机物J结构中含两个环。
回答下列问题:
(1)C的名称是________________。
(2)A→B试剂和反应条件为________________。
(3)H→J的化学反应方程式为_______________。
(4)已知![]() 符合下列条件的 N的同分异构体有___________种,其中核磁共振氢谱显示环上只有 3 组峰,且峰面积之比为 4:4:1,写出符合条件一种同分异构体的结构简式____________。
符合下列条件的 N的同分异构体有___________种,其中核磁共振氢谱显示环上只有 3 组峰,且峰面积之比为 4:4:1,写出符合条件一种同分异构体的结构简式____________。
①含有基团![]() 、环上有三个取代基②与NaHCO3反应产生气泡 ③可发生缩聚反应,M的所有同分异构体在下列表征仪器中显示的信号(或数据)完全相同是_____。
、环上有三个取代基②与NaHCO3反应产生气泡 ③可发生缩聚反应,M的所有同分异构体在下列表征仪器中显示的信号(或数据)完全相同是_____。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(5)利用题中信息和所学知识,写出以A和甲烷为原料,合成![]() 的路线流程图____________(其它试剂自选)。
的路线流程图____________(其它试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β—紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。下列说法正确的是( )
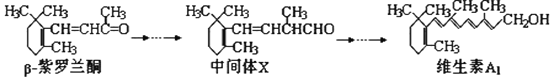
A. β—紫罗兰酮与中间体X互为同分异构体
B. β—紫罗兰酮不可使酸性KMnO4溶液褪色
C. 维生素A1易溶于NaOH溶液
D. 1mol维生素A1最多能与5molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯是重要的化工原料,利用乙苯为初始原料合成高分子化合物J 的流程如图所示(部分产物及反应条件已略去):
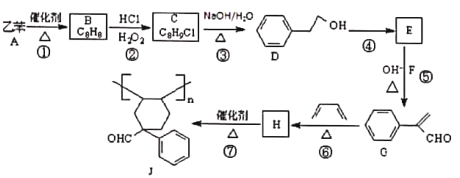
已知:①R1CHO+R2 CH2CHO ![]()
②![]()
(1)物质 B 的名称为 ______________________。
(2)②、③的反应类型分别为 ____________________________。
(3)物质 H 中官能团的名称是 __________________________。
(4)反应⑤的化学方程式为 _________________________________________________。
(5)写出符合下列条件,与G互为同分异构体的芳香族化合物的结构简式:________。
i与Na 反应能够生成氢气; ii. 含碳碳叁键(不考虑“—C≡C—OH ”结构): iii.苯环上只有两个处于对位的取代基iv. 核磁共振氢谱中峰的面积之比为 2:2:2:1:1.
(6)参照上述合成路线和信息, 设计由![]() 、乙醛、苯甲醇合成
、乙醛、苯甲醇合成 的路线(无机试剂任选)。_____________
的路线(无机试剂任选)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L恒容密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)![]() Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是 ( )
Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是 ( )
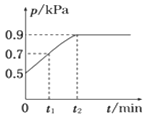
A. 该温度下此反应的平衡常数K=3.2
B. 从反应开始到t1时的平均反应速率v(X)=0.2/t1 mol·L-1·min-1
C. 欲提高平衡体系中Y的百分含量,可加入一定量的X
D. 其他条件不变,再充入0.1 mol气体X,平衡正向移动,X的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,以及少量Fe、Si的化合物,可以用孔雀石为原料制备胆矾( CuSO4·5H2O),步骤如下:
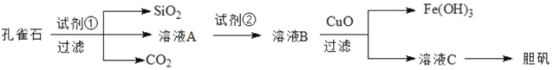
回答下列问题:
(1)试剂①是一种常见的酸,其化学式为______。过滤所需要的玻璃仪器有烧杯、__________。
(2)实验室检验 Fe3+的常用方法是_____________________________________ 。
(3)若溶液A中的金属离子有Cu2+、Fe2+ 、Fe3+,上述流程中需要用试剂②将溶液A中的Fe2+全部转化为Fe3+,从而形成溶液 B,则试剂②能否使用氯水?(填“能”或“不能”,若填“不能”,请解释原因)。_________________
(4)由溶液C获得胆矾,需要经过_______、_____、过滤等操作。
(5)取25.00mL溶液A,用1.000×10-2mol/L的 KMnO4标准溶液滴定。反应离子方程式为:5Fe2++ MnO4-+8H+=5Fe3+ Mn2+ +4H2O,若消耗标准溶液 20.00mL,则溶液A 中Fe2+的浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Ti、Co、Cr、Zn 等元素形成的化合物在现代工业中有广泛的用途。回答下列问题:
(1)下列状态的铝中,电离最外层的一个电子所需能量最小的是_____(填标号)。
A.[Ne]3s1 B.[Ne]3s2 C.[Ne]3s23p1 D.[Ne] 3s13p2
(2)熔融 AlCl3 时可生成具有挥发性的二聚体 Al2Cl6,二聚体 Al2Cl6 的结构式为_____;(标出配位键)其中 Al 的配位数为_________。
(3)与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有_____种。
(4)Co2+的价电子排布式_________。NH3 分子与 Co2+结合成配合物[Co(NH3)6]2+,与游离的氨分子相比,其键角∠HNH_____(填“较大”,“较小”或“相同”),解释原因_____。
(5)已知 CrO5 中铬元素为最高价态,画出其结构式:_____。
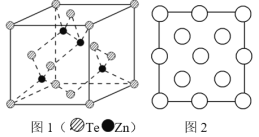
(6)阿伏加德罗常数的测定有多种方法,X 射线衍射法就是其中的一种。通过对碲化锌晶体的 X 射线衍射图 象分析,可以得出其晶胞如图 1 所示,图 2 是该晶胞沿 z 轴的投影图,请在图中圆球上涂“●”标明 Zn 的位置_____。若晶体中 Te 呈立方面心最密堆积方式排列,Te 的半径为 a pm,晶体的密度为 ρg/cm3,阿伏加德罗常数 NA=_____mol-1(列计算式表达)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com