
【题目】设NA表示阿伏伽德罗常数,下列说法正确的是( )
A. 标况下,11.2L氟化氢中含有的电子数5NA
B. 6.0g甲醛(HCHO)和醋酸的混合物中含有的原子总数为0.8NA
C. 100mL 0.1mol/L 的KAl(SO4)2溶液中含有的阳离子总数为0.02NA
D. 分别由H2O2和KMnO4制备等量的氧气转移的电子数目相等
【答案】B
【解析】
A.标况下,氟化氢为液体,不可利用气体摩尔体积计算,故A不正确;
B.甲醛(HCHO)和醋酸的最简式相同,均为CH2O,所以先计算最简式的物质的量,再根据最简式物质的量计算计算混合物中含有的原子总数即可,原子数为![]() 0.8NA,故B正确;
0.8NA,故B正确;
C.因为Al3++3H2O![]() Al(OH)3+3H+,会让阳离子数目略有增加,所以100mL 0.1mol/L 的KAl(SO4)2溶液中含有的阳离子总数略大于0.02NA,故C不正确;
Al(OH)3+3H+,会让阳离子数目略有增加,所以100mL 0.1mol/L 的KAl(SO4)2溶液中含有的阳离子总数略大于0.02NA,故C不正确;
D.2H2O2![]() 2H2O+O2,双氧水中氧元素是从负一价升高到零价,所以每生成1mol氧气转移2mol电子;2KMnO4
2H2O+O2,双氧水中氧元素是从负一价升高到零价,所以每生成1mol氧气转移2mol电子;2KMnO4![]() K2MnO4+MnO2+O2,高锰酸钾中氧元素是从负二价升高到零价,所以每生成1mol氧气转移4mol电子,故D不正确;
K2MnO4+MnO2+O2,高锰酸钾中氧元素是从负二价升高到零价,所以每生成1mol氧气转移4mol电子,故D不正确;
正确答案:B。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 除去水垢中的![]() 常用试剂有碳酸钠和盐酸
常用试剂有碳酸钠和盐酸
B. 煤干馏可以得到焦炉气、粗氨水、芳香族化合物、焦炭等物质
C. 用碘水检验淀粉是否水解完全
D. 天然纤维、合成纤维和人造纤维组成元素完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
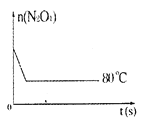
【题目】在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4![]() 2NO2-Q,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2-Q,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为____。
(2)该反应的平衡常数K=___。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色___(填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号)___,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号)___。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近报道的一种处理垃圾渗滤液并用其发电的示意图如下。装置工作时,下列说法不正确的是

A. 化学能转变为电能
B. 盐桥中K+向X极移动
C. 电子由X极沿导线流向Y极
D. Y极发生的反应为2NO3-+10e-+12H+=N2+ 6H2O,周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基钠(NaNH2)是制取靛青染料、肼和氰化钠等工业品的原料,可将氨通过 250 -360℃金属钠制得。氨基钠在空气中易氧化、易燃,与水强烈反应,露置空气中易吸收水分和二氧化碳。某化学实验小组拟采用如图所示的装置制备氨基钠,回答下列相关问题:

(1)上面各装置组装为制取氨基钠装置时,按气体流向合理的连接顺序为___________(选填编号)。
Ⅰ.a-b-c-f-g-d-e-h-i Ⅱ.a-d-e-f-g-h-i-b-c
Ⅲ.a-h-i-f-g-d-e-b-c Ⅳ.a-h-i-b-c-f-g-d-e
(2)仪器组装完成后下一步的操作名称是_________________________________。
(3)A装置中加入试剂合理的是______________________。简述A中产生氨气的原理______________________。
a.浓氨水 b.浓氨水与CaO c.NH4C1与Ca(OH)2
(4)装置B的作用是______________________(答出两条)。
(5)装置C中盛放的试剂为______________________。
(6)下列实验操作步骤合理的顺序为______________________(用步骤序号填空)。
①点燃D处酒精灯加热 ②打开分液漏斗活塞,使产生气体并通入一段时间 ③充分反应后停止加热 ④关闭分液漏斗活塞;步骤②的目的是______________________。
(7)为简化制备装置,甲同学提出可用装有五氧化二磷的球形干燥管代替原装置的末端两个仪器,乙同学认为甲的方案不可行,乙的理由可能是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某Al2(SO4)3溶液VmL中含有a克Al3+,取出![]() mL溶液稀释成3VmL后,硫酸根离子的物质的量浓度为_________。
mL溶液稀释成3VmL后,硫酸根离子的物质的量浓度为_________。
(2)在标准状况下,CO和CO2混合气体的质量为36g,体积为22.4L,则其中CO2所占的体积为______,CO所占的质量为______。
(3)某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8。
①配制该营养液后c(NH4+)=0.016mol/L,溶液中c(K+)=_______________。
②若采用(NH4)2SO4和KCl来配制该营养液,则(NH4)2SO4和KCl物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统接触法制取硫酸能耗大,污染严将燃料电池引人硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。
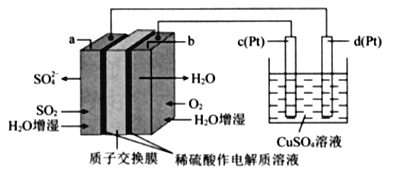
下列说法不正确的是( )
A. b极为正极,电极反应式为O2+4H++4e-=2H20
B. H+由a极通过质子交换膜向b极移动
C. 该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4
D. 若a极消耗2.24 L(标准状况)SO2,理论上c极,有6.4g铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵[(NH4)2SO4]一种优良的氮肥(俗称肥田粉),适用于一般土壤和作物,能使枝叶生长旺盛,提高果实品质和产量,增强作物对灾害的抵抗能力,可作基肥、追肥和种肥,与氢氧化钙在加热的条件下可以生成氨气。根据所学知识回答下列问题:
(1)基态S原子的价电子排布式为____________,能量最高的电子所处的能层的符号为_________。
(2)SO42-空间构型为__________,中心原子的轨道杂化方式是________,写出一个与SO42-互为等电子体的分子的化学式__________。
(3)氨气的沸点(-33.5℃)高于硫化氢的沸点(-60.4℃)的主要原因是:_____________________________。
(4)O、N、S的第一电离能从大到小的顺序是___________________。
(5)硫酸铜溶液中通入过量的氨气会生成[Cu(NH3)4]SO4,1mol的[Cu(NH3)4]2+中σ键的个数为________。
(6)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构如下图所示,这种碳氮化钛化合物的化学式为________。若将该晶体的晶胞重新切割,使碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是__________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙醇和乙酸的说法中,正确的是
A.乙醇和乙酸分子中都含有C=O键B.乙醇和乙酸互为同分异构体
C.乙醇和乙酸均能使紫色石蕊试液变红D.乙醇和乙酸相互之间能溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com