
【题目】盐在化学工业中有重要的应用,请回答下列问题:
(1)用化学方程式表示配制FeCl3溶液时常加入浓盐酸的原因______________________________________________
(2)常温下,在pH=3的Al2(SO4)3溶液与pH=11的Na2S溶液中,水电离出来的c(OH﹣)之比为______,将两溶液混合后,产生白色沉淀和有臭鸡蛋味的气体,其反应的离子方程式为_________________________
(3)c(NH4+)相等的下列溶液①NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4 ⑤NH3·H2O,溶液的物质的量浓度由小到大的顺序是______________________________________________________ (用序号表示)
(4)已知t℃时①AgCl的Ksp=2×10﹣10;②在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列正确的是_______

A.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
B.在t℃时Ag2CrO4的Ksp为1×10-12
C.在t℃时反应:Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
D.在t℃时以0.01mol/L的AgNO3溶液滴定20mL浓度均为0.01mol/L的KCl和K2CrO4的混合溶液,CrO42-先沉淀
【答案】 FeCl3+3H2O![]() Fe(OH)3+3HCl 1:1 2Al3++3S2-+6H2O==2Al(OH)3↓+3H2S↑ ③<②<①<④<⑤ BC
Fe(OH)3+3HCl 1:1 2Al3++3S2-+6H2O==2Al(OH)3↓+3H2S↑ ③<②<①<④<⑤ BC
【解析】试题分析:本题考查盐的水解,盐溶液中水电离的c(OH-)的计算,双水解离子方程式的书写,溶液中粒子浓度大小比较,沉淀溶解平衡曲线的分析。
(1)FeCl3属于强酸弱碱盐,在FeCl3溶液中存在水解平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl,加入浓盐酸,水解平衡向逆反应方向移动,抑制FeCl3的水解,避免出现浑浊。
Fe(OH)3+3HCl,加入浓盐酸,水解平衡向逆反应方向移动,抑制FeCl3的水解,避免出现浑浊。
(2)Al2(SO4)3属于强酸弱碱盐,由于Al3+的水解使溶液呈酸性,pH=3的Al2(SO4)3溶液中c(H+)=1![]() 10-3mol/L,c(OH-)水=c(H+)水=c(H+)溶液=1
10-3mol/L,c(OH-)水=c(H+)水=c(H+)溶液=1![]() 10-3mol/L;Na2S属于强碱弱酸盐,由于S2-的水解使溶液呈碱性,pH=11的Na2S溶液中c(H+)=1
10-3mol/L;Na2S属于强碱弱酸盐,由于S2-的水解使溶液呈碱性,pH=11的Na2S溶液中c(H+)=1![]() 10-11mol/L,常温下c(OH-)=1
10-11mol/L,常温下c(OH-)=1![]() 10-3mol/L,c(OH-)水=c(OH-)溶液=1
10-3mol/L,c(OH-)水=c(OH-)溶液=1![]() 10-3mol/L;两溶液中水电离出来的c(OH-)之比为1:1。Al2(SO4)3溶液和Na2S溶液混合发生双水解反应生成Al(OH)3白色沉淀和臭鸡蛋气味的H2S气体,反应的离子方程式为2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。
10-3mol/L;两溶液中水电离出来的c(OH-)之比为1:1。Al2(SO4)3溶液和Na2S溶液混合发生双水解反应生成Al(OH)3白色沉淀和臭鸡蛋气味的H2S气体,反应的离子方程式为2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。
(3)1molNH4Cl、NH4HSO4、CH3COONH4完全电离产生1molNH4+,1mol(NH4)2SO4完全电离产生2molNH4+,NH3·H2O部分电离产生NH4+,则c(NH4+)相等的溶液中,NH3·H2O(⑤)物质的量浓度最大,(NH4)2SO4溶液(③)物质的量浓度最小;在NH4HSO4溶液中NH4HSO4电离出的H+对NH4+的水解起抑制作用,在CH3COONH4溶液中CH3COO-的水解对NH4+的水解起促进作用,则c(NH4+)相等的溶液中,物质的量浓度:c(CH3COONH4)![]() c(NH4Cl)
c(NH4Cl)![]() c(NH4HSO4);c(NH4+)相等的溶液中,物质的量浓度由小到大的顺序为③
c(NH4HSO4);c(NH4+)相等的溶液中,物质的量浓度由小到大的顺序为③![]() ②
②![]() ①
①![]() ④
④![]() ⑤。
⑤。
(4)A,在Ag2CrO4饱和溶液中存在溶解平衡:Ag2CrO4(s)![]() 2Ag+(aq)+CrO42-(aq),加入K2CrO4,CrO42-浓度增大,平衡逆向移动,Ag+浓度减小,A项错误;B,由图可见当c(CrO42-)=10-6mol/L时,c(Ag+)=10-3mol/L,Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=(10-3)2
2Ag+(aq)+CrO42-(aq),加入K2CrO4,CrO42-浓度增大,平衡逆向移动,Ag+浓度减小,A项错误;B,由图可见当c(CrO42-)=10-6mol/L时,c(Ag+)=10-3mol/L,Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=(10-3)2![]() 10-6=10-12,B项正确;C,反应Ag2CrO4(s)+2Cl-(aq)
10-6=10-12,B项正确;C,反应Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数=
2AgCl(s)+CrO42-(aq)的平衡常数=![]() =
=![]() =
=![]() =
=![]() =2.5
=2.5![]() 107,C项正确;D,Cl-开始沉淀时c(Ag+)=
107,C项正确;D,Cl-开始沉淀时c(Ag+)=![]() =2
=2![]() 10-8mol/L,CrO42-开始沉淀时c(Ag+)=
10-8mol/L,CrO42-开始沉淀时c(Ag+)=![]() =1
=1![]() 10-5mol/L
10-5mol/L![]() 2
2![]() 10-8mol/L,Cl-先沉淀,D项错误;答案选BC。
10-8mol/L,Cl-先沉淀,D项错误;答案选BC。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态As原子的核外电子排布式为[Ar]_________;As原子的逐级电离能(kJ/mol)数据如下:
第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | 第五电离能 | 第六电离能 |
947.0 | 1798 | 2735 | 4837 | 6043 | 12310 |
第五电离能与第六电离能相差显著的原因:_____________________________________。
(2)红磷是巨型共价分子,无定型结构。能证明红磷是非晶体的最可靠方法是__________。
A.质谱 B.原子发射光谱 C.核磁共振谱 D.X射线衍射
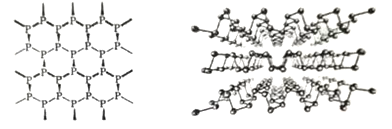
(3)黑磷是新型二维半导体材料,具有类似石墨一样的片层结构(如图),层与层之间以_____结合。从结构上看,单层磷烯导电性优于石墨烯的原因是____________________________。
(4)白磷(P4)分子是正四面体结构,3.1g白磷中σ键的数目为________;白磷(P4)易溶于二硫化碳,难溶于水,其原因是_____________________________________________。
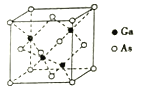
(5)GaAs的熔点为1238℃,其晶胞结构如图所示。该晶体的类型为_________,Ga原子的杂化方式为______________,每个As原子周围最近的As原子数目为________。已知GaAs的密度为dg/cm3,摩尔质量为Mg/mol,则晶胞中最近的As和Ga原子核间距为_____(阿伏加德罗常数值用NA表示,列出算式即可)nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以NaBH4(B为+3价)和H2O2做原料的新型燃料电池可用作深水勘探等无空气环境下的电源,其结构如右图所示.该电池总反应式为:NaBH4+4H2O2=NaBO2+6H2O,下列的说法正确是( )
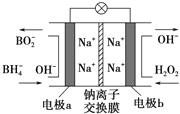
A. 放电过程中,Na+从右向左迁移
B. a为正极,其电极反应为:BH4--8e-+8OH-=BO2-+6H2O
C. b电极的电极反应式为:H2O2+2e-+2H+=2H2O
D. 每消耗300g、34%的H2O2溶液,理论上流过电路中的电子数为6NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下6个反应(反应条件略):
A.2Na+2H2O ═2NaOH+H2↑ B.CH4+2O2 ![]() CO2+2H2O
CO2+2H2O
C.KClO3![]() 2KCl+3O2↑ D.CaCO3+2HCl═CaCl2+H2O+CO2↑
2KCl+3O2↑ D.CaCO3+2HCl═CaCl2+H2O+CO2↑
E.Na2O+CO2 ═Na2CO3 F.CO2+C![]() 2CO
2CO
既属于化合反应又属于氧化还原反应的有__________(填编号,下同),不属于氧化还原反应的有__________.
(2)根据反应:①2Fe3++2I-===2Fe2++I2,②Br2+2Fe2+===2Fe3++2Br-,③ Br2+2I-===I2+2Br-,回答下列问题。
①试判断离子的还原性由强到弱的顺序是________
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
②某溶液中含有Br-、Fe2+、I-,为了氧化I-而不影响Br-和Fe2+,选用的氧化剂是__________;
③I2与Br-能否发生反应________
A.能 B.不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH==5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2是氧化剂,NaOH是还原剂
B. 被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
C. Cl2既做氧化剂又做还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应KMn04+ HCl—KC1+ MnCl2+Cl2+ H20(未配平),若有0.1 mol KMn04参加反应,下列说法正确的是 ( )
A. 转移0.5 mol电子 B. 生成0.5 mol Cl2
C. 参加反应的HC1为1.6 mol D. Cl2是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣(有效成分为 Fe2O3 和 Fe3O4)制备 PFS,其工艺流程如下图所示。
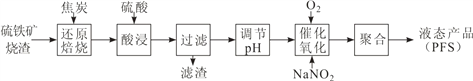
(1)CO是“还原焙烧”过程的主要还原剂。下图中,曲线表示 4 个化学反应 a、b、c、d 达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是 Fe2O3、Fe3O4、FeO、Fe 稳定存在的区域。a属于__________(填“吸热反应”或“放热反应”);570℃时,d 反应的平衡常数 K=___________________。
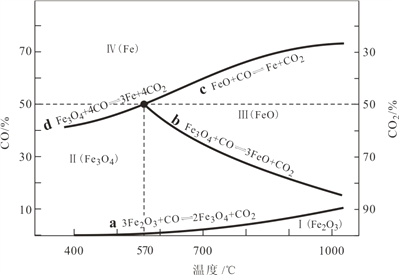
(2)800℃,混合气体中CO2的体积分数为40%时,Fe2O3用CO还原焙烧过程中发生的主要的化学反应方程式:________________________________________________
(3)若“酸浸”时间过长,浸出液 Fe2+含量反而降低,主要原因是___________________。
(4)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17,Ksp[Fe(OH)3]=1.0×10-39。若浸出液中c(Fe3+) = 10-1.8mol·L-1,为避免“催化氧化”过程中产生副产物 Fe(OH)3,应调节浸出液的 pH≤___________。
(5)FeSO4 溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4 ,该反应的离子方程式_____________________________________.
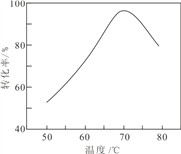
(6)“催化氧化”过程中,用 NaNO2 作催化剂(NO 起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+ 转化率随温度的升高先上升后下降的原因是___________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
![]() (浓)
(浓)![]()
![]()
试完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______(用字母代号填写)
a.酸 b. 碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)该反应中被氧化的元素是_________________,参加反应的氧化剂与还原剂的物质的量之比为______。
(3)写出该反应的化学方程式并用双线桥标出电子转移的方向和数目:____________。
(4)一定量的铜片与100mL 18 mol/L的浓![]() 充分反应,如果该反应过程中转移了0.2mol电子,生成的
充分反应,如果该反应过程中转移了0.2mol电子,生成的![]() 的质量为_________g,生成的A气体在标准状况下体积为________L(假设气体全部逸出)。
的质量为_________g,生成的A气体在标准状况下体积为________L(假设气体全部逸出)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com